
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
| A、Mg、Ag |
| B、Fe、Mg |
| C、Al、Cu |
| D、Mg、Al |
查看答案和解析>>
科目: 来源: 题型:
| 选项 | 实验目的 | 实验方案 |
| A | 检验CH3CH2Br在NaOH溶液中是否发生水解 | 将CH3CH2Br与NaOH溶液共热.冷却后,取出上层水溶液,加入AgNO3溶液,观察是否产生淡黄色沉淀 |
| B | 检验Fe(NO3)2晶体是否已氧化变质 | 将Fe(NO3)2样品溶于稀H2SO4后,滴加KSCN溶液,观察溶液是否变红 |
| C | 验证氧化性:Fe3+>I2 | 将KI和FeCl3溶液在试管中混合后,振荡,静置.可观察溶液颜色变化 |
| D | 验证Fe(OH)3的溶解度小于Mg(OH)2 | 将FeCl3溶液加入Mg(OH)2悬浊液中,振荡,可观察到沉淀由白色变为红褐色 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目: 来源: 题型:
| A、电化学反应不一定是氧化还原反应 |
| B、pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,水的电离程度相同 |
| C、根据某反应的△H<0,判断该反应在此条件下一定能自发进行 |
| D、已知BaSO4和BaCO3的Ksp相近.用饱和Na2CO3溶液处理BaSO4沉淀,可将BaSO4转化为BaCO3 |
查看答案和解析>>
科目: 来源: 题型:
| X | |||
| Y | Z | W |
| A、原子半径:Y<Z<W |
| B、气态氢化物的稳定性:X>Z |
| C、W的最高价氧化物与水反应形成的化合物是离子化合物 |
| D、X的气态氢化物的水溶液能与Y的最高价氧化物对应水化物发生反应 |
查看答案和解析>>
科目: 来源: 题型:
 ,不符合
,不符合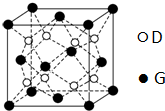
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
 SO2、NOx是大气的主要污染物.
SO2、NOx是大气的主要污染物.查看答案和解析>>
科目: 来源: 题型:
| A、16mol/(L?s) |
| B、24 mol/(L?s) |
| C、32mol/(L?s) |
| D、48 mol/(L?s) |
查看答案和解析>>
科目: 来源: 题型:


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com