
科目: 来源: 题型:
| A、由于Ksp(BaSO4)=1.1×10-10小于Ksp(BaCO3)=5.1×10-9,则不能使BaSO4沉淀转化为BaCO3沉淀 |
| B、在中和热测定的实验中,将NaOH溶液和盐酸混合反应后的最高温度作为末温度 |
| C、除去CH3COOC2H5中的CH3COOH先加足量的饱和Na2CO3溶液再蒸馏 |
| D、能使湿润的KI淀粉试纸变蓝的气体一定是Cl2 |
查看答案和解析>>
科目: 来源: 题型:
| A、反应达平衡时N2的转化率为7.5% |
| B、反应进行到10s末时,H2的平均反应速率是0.0225mol?(L?s)-1 |
| C、该反应达到平衡时的标志是容器中气体压强不再改变 |
| D、该反应达到平衡时的标志是容器中气体密度不再改变 |
查看答案和解析>>
科目: 来源: 题型:
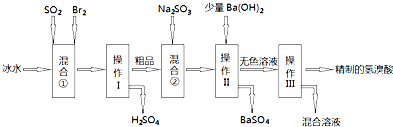
查看答案和解析>>
科目: 来源: 题型:
| A、在AgCl的沉淀溶解平衡体系中,加入蒸馏水,Ksp(AgCl)增大 |
| B、可直接根据Ksp的数值大小比较难溶物在水中的溶解度大小 |
| C、在CaCO3的沉淀溶解平衡体系中,加入稀盐酸,平衡不移动 |
| D、25℃时,Ksp(AgCl)>Ksp(AgI),向AgCl的悬浊液中加入KI溶液,有黄色沉淀生成 |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
| 物质 | HF | H3PO4 |
| 电离平衡常数 | K=3.6×10-4 | 7.5×10-3 K2=6.2×10-8 K3=2.2×10-13 |
| A、在等浓度的NaF、NaH2PO4混合溶液中,c(Na+)+c(H+)=c(F-)+c(H2PO4-)+c(OH-) |
| B、少量H3PO4和NaF反应的离子方程式为:H3PO4+F-=H2PO4-+HF |
| C、同温同浓度时,溶液的pH:NaF>NaH2PO4>Na2HPO4 |
| D、结合H+的能力:F->HPO42->PO43- |
查看答案和解析>>
科目: 来源: 题型:
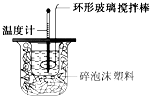 某实验小组用0.50mol?L-1 NaOH溶液和0.55mol?L-1盐酸溶液进行中和热的测定.Ⅰ.配制0.50mol?L-1 NaOH溶液
某实验小组用0.50mol?L-1 NaOH溶液和0.55mol?L-1盐酸溶液进行中和热的测定.Ⅰ.配制0.50mol?L-1 NaOH溶液查看答案和解析>>
科目: 来源: 题型:
 将V1 mL 1.00mol?L-1 HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL).下列叙述正确的是( )
将V1 mL 1.00mol?L-1 HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL).下列叙述正确的是( )| A、做该实验时环境温度为22℃ |
| B、该实验表明所有化学反应化学能只转化为热能 |
| C、NaOH溶液的浓度为1.50 mol?L-1 |
| D、该实验表明有水生成的反应都是放热反应 |
查看答案和解析>>
科目: 来源: 题型:
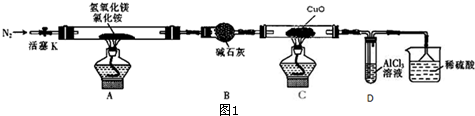
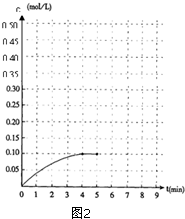 内加入0.2mol的N2和0.6mol 的H2,在一定条件下发生如下反应:N2 (g)+3H2(g)?2NH3(g)△H<0.反应中NH3的物质的量浓度的变化的情况如图2:
内加入0.2mol的N2和0.6mol 的H2,在一定条件下发生如下反应:N2 (g)+3H2(g)?2NH3(g)△H<0.反应中NH3的物质的量浓度的变化的情况如图2:查看答案和解析>>
科目: 来源: 题型:
| ||
| H+ |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com