
科目: 来源: 题型:
A、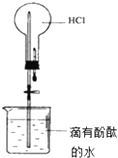 打开止水夹,烧瓶内出现红色喷泉 |
B、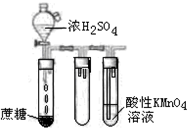 酸性KMnO4溶液中出现气泡,颜色无明显变化 |
C、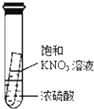 静置一段时间,小试管内有晶体析出 |
D、 烧杯中液体变为红褐色后,继续加热煮沸,会出现浑浊 |
查看答案和解析>>
科目: 来源: 题型:
| 1 |
| 3 |
| 2 |
| 3 |
| 1 |
| 3 |
| A、-218kJ?mol-1 |
| B、-109kJ?mol-1 |
| C、+218kJ?mol-1 |
| D、+109kJ?mol-1 |
查看答案和解析>>
科目: 来源: 题型:
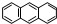 分子式C14H10)反应生成蒽醌(
分子式C14H10)反应生成蒽醌( 分子式C14H8O2),反应式为(未配平)C14H10(蒽)+KMnO4+H2SO4→C14H8O2(蒽醌)+K2SO4+MnSO4+H2O.
分子式C14H8O2),反应式为(未配平)C14H10(蒽)+KMnO4+H2SO4→C14H8O2(蒽醌)+K2SO4+MnSO4+H2O.查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
| n(CH3OH) |
| n(CO2) |

查看答案和解析>>
科目: 来源: 题型:

查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com