
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
| A、v(C)=v(A)=0.2 mol?L-1?s-1 |
| B、z=3 |
| C、B的转化率为75% |
| D、反应前与2 s后容器的压强比为4:3 |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
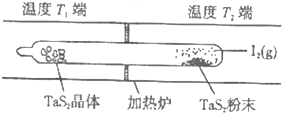 (1)等物质的量的A、B、C、D四种物质混合,发生如下反应:aA+bB?cC(s)+dD.当反应进行一段时间后,测得A减少了n mol,B减少了
(1)等物质的量的A、B、C、D四种物质混合,发生如下反应:aA+bB?cC(s)+dD.当反应进行一段时间后,测得A减少了n mol,B减少了| n |
| 2 |
| 3 |
| 2 |
查看答案和解析>>
科目: 来源: 题型:
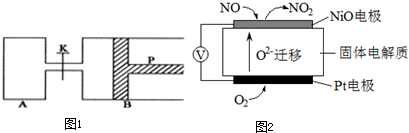
查看答案和解析>>
科目: 来源: 题型:
| A、由石墨比金刚石稳定可知:C(金刚石,s)═C(石墨,s)△H<0 |
| B、在101 kPa时,1 mol H2完全燃烧生成液态水,放出285.8 kJ热量,H2的燃烧热为-285.8 kJ?mol-1 |
| C、在101 kPa时,1 mol C与适量O2反应生成1 mol CO时,放出110.5 kJ热量,则C的燃烧热为110.5 kJ?mol-1 |
| D、在稀溶液中:H+ (aq)+OH- (aq)═H2O(l)△H=-57.31 kJ?mol-1,若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,放出的热量等于57.31 kJ |
查看答案和解析>>
科目: 来源: 题型:
| 高温 |
| 温度 | 25℃~550℃~600℃~700℃ |
| 主要成份 | WO3 W2O5 WO2 W |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
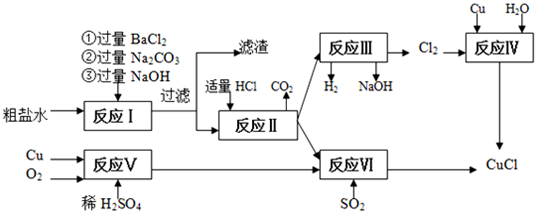
查看答案和解析>>
科目: 来源: 题型:
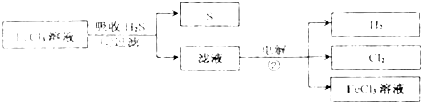
| A、可采取在足量空气中充分燃烧的方法消除H2S的污染 |
| B、反应②中的阴极反应式为2H++2e-═H2↑,电解后所得溶液呈酸性 |
| C、如反应①中H2S过量,则反应离子方程式为:2Fe3++3H2S═2FeS↓+S↓+6H+ |
| D、此反应流程图中可循环利用的物质是FeCl3溶液,FeCl3可用作杀菌、消毒剂和净水剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com