
科目: 来源: 题型:
| 1 |
| 2 |
| 时间/min | 5 | 10 | 15 | 20 | 25 | 30 |
| c(NH3)/( mol?/L-1) | 0.08 | 0.14 | 0.18 | 0.20 | 0.20 | 0.20 |
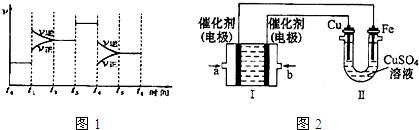
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
| A、除去 CO2 中混有的 CO:用澄清石灰水洗气 |
| B、除去 BaCO3 固体中混有的 BaSO4:加过量盐酸后,过滤、洗涤 |
| C、除去 FeCl2 溶液中混有的 FeCl3:加入过量铁粉,过滤 |
| D、除去 Cu 粉中混有的 CuO:加适量稀硝酸后,过滤、洗涤 |
查看答案和解析>>
科目: 来源: 题型:
| 步骤 | 操作 | 现象 |
| ① | 用pH试纸检验 | 溶液的pH大于7 |
| ② | 向溶液中滴加氯水,再加入CCl4振荡,静置 | CCl4层呈紫红色 |
| ③ | 向所得水溶液中加入Ba(NO3)2溶液和稀HNO3 | 有白色沉淀产生 |
| ④ | 过滤,向滤液中加入AgNO3溶液和稀HNO3 | 有白色沉淀产生 |
| A、肯定含有的离子是③④⑤ |
| B、肯定没有的离子是②⑤ |
| C、不能确定的离子是③⑥ |
| D、可能含有的离子是①⑥ |
查看答案和解析>>
科目: 来源: 题型:
| Fe2O3 | CO | Fe | CO2 | |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/mol | 1.0 | 2.0 | 1.0 | 1.0 |
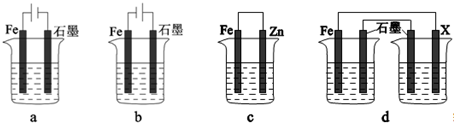
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
| 起始n(M):n(H2O) | M转化率 | H2O转化率 |
| 1:1 | 0.5 | 0.5 |
| 1:2 | 0.67 | 0.33 |
| 1:3 | 0.75 | 0.25 |
查看答案和解析>>
科目: 来源: 题型:
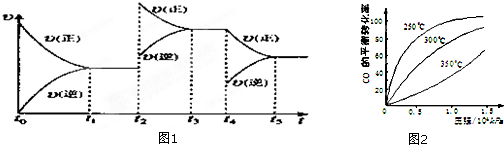
查看答案和解析>>
科目: 来源: 题型:
| A、当温度升高时,弱酸的电离平衡常数Ka变小 |
| B、某温度下的醋酸铵溶液呈中性,则溶液中c(H+)=c(OH-)=10-7mol/L |
| C、由Ksp(AgCl)>Ksp(AgI)可判断AgCl(s)+I-(aq)=AgI(s)+Cl-(aq)能发生 |
| D、常温下,pH=12氨水与pH=2盐酸等体积混合c(Cl-)>c(NH+4)>c(H+)>c(OH-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com