
科目: 来源: 题型:
| 实验方案 | 使用试剂 | 判断方法 |
| ① | 铁粉 | 如果有气泡,表明盐酸已经过量 |
| ② | pH试纸 | 如果pH<7,表明盐酸已经过量 |
| ③ | 硝酸银溶液 | 如果有白色沉淀产生,表明盐酸已经过量 |
| ④ | 紫色石蕊试液 | 如果溶液变成红色,表明盐酸已经过量 |
| A、① | B、② | C、③ | D、④ |
查看答案和解析>>
科目: 来源: 题型:
| A、Ba(OH)2、KSCN、NaCl、K2SO4(FeCl3溶液) |
| B、NaNO3、NaHCO3、Na2SO3、Na2SiO3(H2SO4溶液) |
| C、NaBr、Na2CO3、KI、CaCl2(AgNO3溶液) |
| D、NH4Cl、Mg(NO3)2、CuSO4、AlCl3(KOH溶液) |
查看答案和解析>>
科目: 来源: 题型:
| 序号 | 反应 温度/℃ | c(HCl)/ mol?L-1 | V(HCl) /mL | 10g碳酸钙的形状 | t/min |
| 1 | 20 | 2 | 10 | 块状 | t1 |
| 2 | 20 | 2 | 10 | 粉末 | t2 |
| 3 | 20 | 4 | 10 | 粉末 | t3 |
| 4 | 40 | 2 | 10 | 粉末 | t4 |
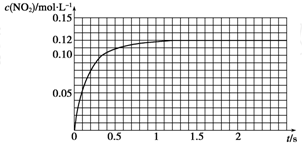
查看答案和解析>>
科目: 来源: 题型:
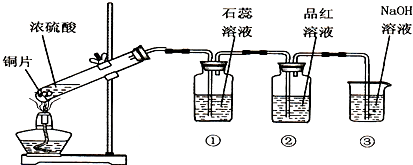
查看答案和解析>>
科目: 来源: 题型:
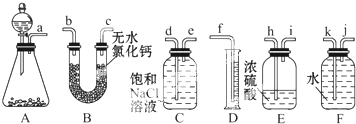
查看答案和解析>>
科目: 来源: 题型:
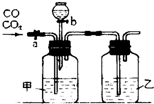 某学生用如图装置进行一氧化碳和二氧化碳混合气体的分离提纯及干燥.其中a为弹簧夹,b为分液漏斗的活塞.
某学生用如图装置进行一氧化碳和二氧化碳混合气体的分离提纯及干燥.其中a为弹簧夹,b为分液漏斗的活塞.查看答案和解析>>
科目: 来源: 题型:
| 一定条件 |
 发生此反应时断裂的化学键应是( )
发生此反应时断裂的化学键应是( )| A、①④ | B、①③ | C、② | D、②③ |
查看答案和解析>>
科目: 来源: 题型:
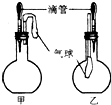 如图所示的甲、乙两个装置中,胶头滴管中吸入某种液体,平底烧瓶中充入(或放入)另一种物质,挤压胶头滴管加入液体,一段时间后两装置中的气球都明显胀大(忽略液体体积对气球的影响).则滴管和烧瓶中所用试剂不可能是( )
如图所示的甲、乙两个装置中,胶头滴管中吸入某种液体,平底烧瓶中充入(或放入)另一种物质,挤压胶头滴管加入液体,一段时间后两装置中的气球都明显胀大(忽略液体体积对气球的影响).则滴管和烧瓶中所用试剂不可能是( )| 甲 | 乙 | |
| A | 水和过氧化钠 | 盐酸和NH3 |
| B | 双氧水和MnO2 | 水和NO |
| C | 盐酸和NaHCO3固体 | NaOH溶液和Cl2 |
| D | 饱和食盐水和电石 | 酸性高锰酸钾溶液和SO2 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目: 来源: 题型:
| 1 |
| 2 |
| 1 |
| 3 |
| a |
| 2 |
查看答案和解析>>
科目: 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com