
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
A Z |
查看答案和解析>>
科目: 来源: 题型:
| A、在NaAlO2溶液中加入过量盐酸溶液 |
| B、在AlCl3溶液中加入过量氨水 |
| C、在AlCl3溶液中加入过量NaOH溶液 |
| D、用Al2O3与水反应 |
查看答案和解析>>
科目: 来源: 题型:
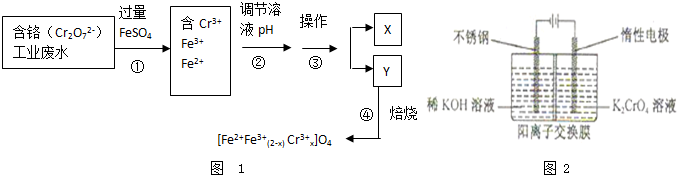
| 样品序号 | 取样深度(m) | 有机质(×10-2g) | 总铬(×10-6g) |
| 样品A-1 | 0.00~0.30 | 2.81 | 114 |
| 样品A-2 | 0.30~0.60 | 1.72 | 111 |
| 样品A-3 | 1.20~1.80 | 1.00 | 88 |
| 样品B-1 | 0.00~0.30 | 2.60 | 116 |
| 样品B-2 | 0.30~0.60 | 2.48 | 112 |
| 样品B-3 | 1.20~1.80 | 1.83 | 106 |
| ||
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/(mol?L-1) | 1.44 | 9.6 | 9.6 |
| 催化剂 |
| n(H2) |
| n(CO2) |
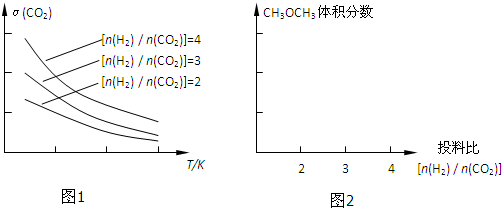
| n(H2) |
| n(CO2) |
查看答案和解析>>
科目: 来源: 题型:
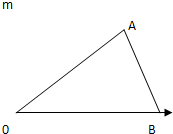 向Al2 (SO4)3逐滴加入NaOH溶液得到沉淀如图
向Al2 (SO4)3逐滴加入NaOH溶液得到沉淀如图查看答案和解析>>
科目: 来源: 题型:
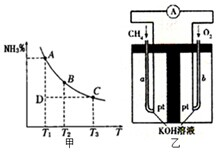 运用化学反应原理研究碳、氮的单质及其化合物的反应具有重要意义.
运用化学反应原理研究碳、氮的单质及其化合物的反应具有重要意义.| c(H+) |
| c(OH-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com