
科目: 来源: 题型:
| 起始 n(A)/mol | 起始 n(B)/mol | 起始 n(C)/mol | 起始 n(D)/mol | 达到平衡时放出(或吸收)的热量 |
| 0 | 1.6 | 8 | 足量 |
查看答案和解析>>
科目: 来源: 题型:
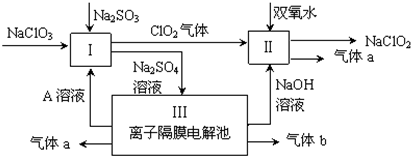
查看答案和解析>>
科目: 来源: 题型:
| A、用澄清石灰水鉴别氢气和一氧化碳 |
| B、用无色酚酞鉴别碳酸钠溶液和氢氧化钠溶液 |
| C、用食盐水鉴别硬水和软水 |
| D、用水鉴别硝酸铵固体和氢氧化钠固体 |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
| 白色粉末的成分 | 形成的原因 |
| 可能是CaCO3. | |
| 可能是 | 暑假气温较高,溶质的溶解度降低或溶剂蒸发,石灰水中的溶质结晶析出. |
| OH- | Cl- | CO32- | NO3- | |
| Ca2+ | 微 | 溶 | 不 | 溶 |
| 实 验 步 骤 | 可能观察到的现象 | 结 论 |
| 取上述试管中的上层清液,滴加1~2酚酞试液. | ||
| 往上述试管中残留的固体中加入稀盐酸. | 白色粉末中 (选填“有”或“无”)CaCO3. |
查看答案和解析>>
科目: 来源: 题型:
| ||
查看答案和解析>>
科目: 来源: 题型:
| A、已知Cu2O+2H+═Cu2++Cu+H2O,氢气还原氧化铜后生成的红色固体能完全溶于稀硝酸,说明还原产物是铜 |
| B、在中和热测定的实验中,将NaOH溶液和盐酸混合反应后的冷却温度作为末温度 |
| C、仅用淀粉溶液、稀硫酸、碘水、新制氢氧化铜四种试剂可完成淀粉水解产物及水解程度检验的探究实验 |
| D、向盛有少量Mg(OH)2悬浊液的试管中滴加氯化铵溶液,可以看到沉淀溶解 |
查看答案和解析>>
科目: 来源: 题型:
| A、将一小块铜片放入盛有浓硫酸的试管中加热反应后的溶液呈蓝色 |
| B、将一小块钠放入盛有水的烧杯中,钠在水面上游动,同时看到烧杯内的溶液变为红色 |
C、 如图,一段时间后给烧杯内的溶液中加入黄色的K3[Fe(CN)6]溶液,可看到Fe电极附近有蓝色沉淀生成 |
| D、向盛有少量Mg(OH)2沉淀悬浊液的试管中滴加氯化铵溶液,可看到沉淀溶解 |
查看答案和解析>>
科目: 来源: 题型:
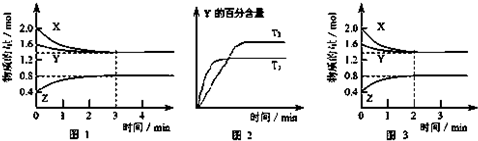
查看答案和解析>>
科目: 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com