
科目: 来源: 题型:
| 阳离子 | Ag+ Na+ |
| 阴离子 | NO3- SO42- Cl- |
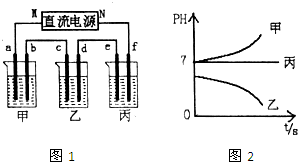
查看答案和解析>>
科目: 来源: 题型:
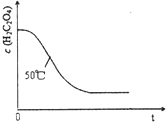
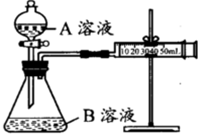 甲、乙两个实验小组分别利用KMnO4酸性溶液与H2C2O4溶液反应进行研究外界因素对反应速率的影响.设计实验方案如下:
甲、乙两个实验小组分别利用KMnO4酸性溶液与H2C2O4溶液反应进行研究外界因素对反应速率的影响.设计实验方案如下:| 序号 | A溶液 | B溶液 |
| ① | 2mL 0.1mol/L H2C2O4溶液 | 4mL 0.01mol/L KMnO4溶液 |
| ② | 2mL 0.2mol/L H2C2O4溶液 | 4mL 0.01mol/L KMnO4溶液 |
| 时间(min) | 4 | 8 | 12 | 16 | 21 | 22 | 23 | 24 | 25 |
| c(KMnO4)(10-4mol/L) | 4.58 | 4.02 | 3.36 | 2.25 | 0.72 | 0.43 | 0.23 | 0.16 | 0.13 |
| υ(KMnO4)(10-4mol/(L?min) | υ | 0.14 | 0.17 | 0.28 | 0.32 | 0.29 | 0.20 | 0.07 | 0.03 |
| 实验步骤及结论: |
查看答案和解析>>
科目: 来源: 题型:
| 实验 | 反应温度/℃ | Na2S2O3溶液 | 稀H2SO4 | H2O | ||
| V/mL | c/(mol?L-1) | V/mL | c/(mol?L-1) | V/mL | ||
| A | 10 | 5 | 0.1 | 5 | 0.1 | 5 |
| B | 10 | 5 | 0.1 | 5 | 0.1 | 10 |
| C | 30 | 5 | 0.1 | 5 | 0.1 | 5 |
| D | 30 | 5 | 0.2 | 5 | 0.2 | 10 |
查看答案和解析>>
科目: 来源: 题型:
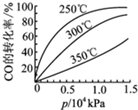 高炉炼铁过程中发生的主要反应为
高炉炼铁过程中发生的主要反应为| 1 |
| 3 |
| 2 |
| 3 |
| 温度/℃ | 1000 | 1150 | 1300 |
| 平衡常数 | 4.0 | 3.7 | 3.5 |
查看答案和解析>>
科目: 来源: 题型:
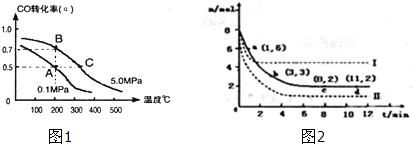
查看答案和解析>>
科目: 来源: 题型:
| A、181:209 | B、28:44 |
| C、1:2 | D、1:1 |
查看答案和解析>>
科目: 来源: 题型:
| A、2:3 | B、3:2 |
| C、2:1 | D、1:2 |
查看答案和解析>>
科目: 来源: 题型:
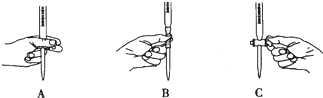
| 实验编号 | 温度(℃) | 催化剂 用量(g) | 酸性高锰酸钾溶液 | 实验目的 a.实验1和2探究 b.实验1和3探究反应物浓度对该反应速率的影响; c.实验1和4探究催化剂对该反应速率的影响. | |
| 体积 (mL) | 浓度 (mol?L-1) | ||||
| 1 | 25 | 0.5 | 4 | 0.1000 | |
| 2 | 50 | 0.5 | 4 | 0.1000 | |
| 3 | 25 | 0.5 | 4 | 0.0100 | |
| 4 | 25 | 0 | 4 | 0.1000 | |
| 实验编号 | 溶液褪色所需时间(min) | ||
| 第1次 | 第2次 | 第3次 | |
| 1 | 14.0 | 13.0 | 11.0 |
| 3 | 6.5 | 6.7 | 6.8 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com