
科目: 来源: 题型:
| A、丁达尔效应可以用于区别FeCl3溶液和Fe(OH)3胶体 |
| B、过滤和蒸发操作均用到玻璃棒,但玻璃棒的作用不相同 |
| C、加入盐酸,能产生使澄清石灰水变浑浊的气体,则溶液中一定含有CO32- |
| D、先加入BaCl2溶液,再加入HNO3溶液,产生了白色沉淀,则溶液中一定含有大量的SO42- |
查看答案和解析>>
科目: 来源: 题型:
| A、1组 | B、2组 | C、3组 | D、4组 |
查看答案和解析>>
科目: 来源: 题型:
| A、MnO2CuO FeO |
| B、Na2CO3CaCO3 K2CO3 |
| C、AgNO3KNO3 Na2CO3 |
| D、(NH4)2SO4 K2SO4 NH4Cl |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
| A、碘是人体必需的微量元素,所以要多吃富含I2的食物 |
| B、金属钠、钾、锂保存在煤油中 |
| C、碳酸钠溶液用带磨口玻璃塞的普通试剂瓶贮存 |
| D、量筒、容量瓶、滴定管上均标有温度 |
查看答案和解析>>
科目: 来源: 题型:
| A、纤维素和淀粉遇碘水均显蓝色 |
| B、蛋白质、乙酸和葡萄糖均属电解质 |
| C、乙酸乙酯和食用植物油均可水解生成乙醇 |
| D、红外光谱仪、核磁共振仪、质谱仪都可用于有机化合物结构的分析 |
查看答案和解析>>
科目: 来源: 题型:
| A、①②④ | B、③④⑤ |
| C、②③④ | D、②③⑤ |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
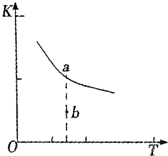 利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤.
利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com