
科目: 来源: 题型:
| n |
| 3 |
| 2n |
| 3 |
| A、3:1:2:1 |
| B、1:3:2:2 |
| C、1:3:1:2 |
| D、3:1:2:2 |
查看答案和解析>>
科目: 来源: 题型:
 氮气是空气中含量最多的一种气体,氮气及其化合物在工农业生产、生活中有着广泛的应用.请回答下列问题:
氮气是空气中含量最多的一种气体,氮气及其化合物在工农业生产、生活中有着广泛的应用.请回答下列问题:| T(K) | 298 | 398 | 498 | … |
| K | 4.1×106 | K1 | K2 | … |
查看答案和解析>>
科目: 来源: 题型:
| A、3:2:1 |
| B、4:3:1 |
| C、5:2:3 |
| D、5:4:1 |
查看答案和解析>>
科目: 来源: 题型:
| A、c1:c2=1:3 |
| B、N2、H2的转化率不相等 |
| C、平衡时,H2和NH3的生成速率之比为3:2 |
| D、c1的取值范围为0<c1<0.14 mol/L |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
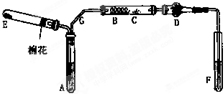 如图是某化学兴趣小组设计的乙醇催化氧化的实验装置(图中加热仪器、铁架台、试管夹均未画出).图中A处为无水乙醇(沸点78℃),B处为绕成螺旋状的细铜丝或银丝,C处为无水CuSO4粉末,D处为碱石灰,F处为新制的碱性Cu(OH)2悬浊液.
如图是某化学兴趣小组设计的乙醇催化氧化的实验装置(图中加热仪器、铁架台、试管夹均未画出).图中A处为无水乙醇(沸点78℃),B处为绕成螺旋状的细铜丝或银丝,C处为无水CuSO4粉末,D处为碱石灰,F处为新制的碱性Cu(OH)2悬浊液.查看答案和解析>>
科目: 来源: 题型:

查看答案和解析>>
科目: 来源: 题型:
| A、平衡前,随着反应的进行,容器内气体密度逐渐减小 |
| B、平衡时,若断裂π键0.4 mol,则放出的热量为18.48 kJ |
| C、平衡后,再向容器中通入1 mol氦气,H2的转化率增大 |
| D、平衡后,缩小容器体积,N2的浓度减小 |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
| A、0.92g |
| B、1.07g |
| C、1.15g |
| D、1.23g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com