
科目: 来源: 题型:
| A、分子式为C4H8有机物最多存在4个C-C单键 |
B、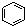 和 和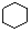 均是芳香烃, 均是芳香烃,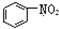 既是芳香烃又是芳香化合物 既是芳香烃又是芳香化合物 |
C、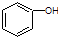 和 和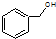 分子组成相差一个-CH2-,因此是同系物关系 分子组成相差一个-CH2-,因此是同系物关系 |
| D、乙酸分子中含有碳氧双键,所以它能使溴水褪色 |
查看答案和解析>>
科目: 来源: 题型:
| A | B | C | D |
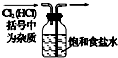 |  | 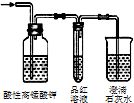 | 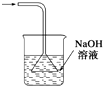 |
| 除去氯气中的杂质 | 制取84消毒液(NaClO) | 检验二氧化硫中是否混有二氧化碳 | 吸收氯化氢尾气 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
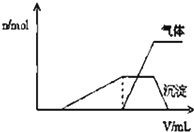 1L某混合溶液中可能含有的离子如下表:
1L某混合溶液中可能含有的离子如下表:| 可能大量含有的阳离子 | H+NH4+Al3+K+ |
| 可能大量含有的阴离子 | Cl-Br-I?ClO?AlO2- |
| Cl2的体积 (标准状况) | 2.8L | 5.6L | 11.2L |
| n(Cl-) | 1.25mol | 1.5mol | 2mol |
| n(Br-) | 1.5mol | 1.4mol | 0.9mol |
| n(I-) | a mol | 0 | 0 |
查看答案和解析>>
科目: 来源: 题型:
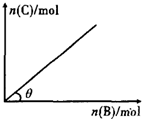 一定条件下,恒容的密闭容器中,加人一定量的A与B发生反应A(s)+2B(g)?C(g)+2D(g)△H<0,平衡时C的物质的量与加入B的物质的量的变化关系如图所示.下列说法正确的是( )
一定条件下,恒容的密闭容器中,加人一定量的A与B发生反应A(s)+2B(g)?C(g)+2D(g)△H<0,平衡时C的物质的量与加入B的物质的量的变化关系如图所示.下列说法正确的是( )| A、增加A的物质的量,正反应速率加快 |
| B、平衡时,其他条件不变,当温度升高时,θ变大 |
| C、图中曲线的斜率表示反应的化学平衡常数 |
| D、平衡时,其他条件不变,再通入B,则反应混合物的温度升高 |
查看答案和解析>>
科目: 来源: 题型:
| 1 |
| 2 |
| A、920 kJ |
| B、557 kJ |
| C、436 kJ |
| D、188 kJ |
查看答案和解析>>
科目: 来源: 题型:
| 实验序号 | 加入n(NaCl)/mol | 测得溶液中n(Cu2+)/mol | 测得溶液中n(Cl-)/mol |
| 1 | 3 | 0 | 1 |
| 2 | 2.4 | 0 | 0.4 |
| 3 | 2 | 0 | 0 |
| 4 | 1.2 | 0 | 0 |
| 5 | 1 | 0 | 0 |
| 6 | 0.4 | 0.2 | 0 |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
| A、溶液中始终有:c(Na+)+c(H+)═2c(S2-)+c(HS-)+c(OH-) |
| B、t溶液呈中性时:c(Na+)═c(HS-)+c(S2-) |
| C、等体积混合后溶液中一定有:c(H2S)+c(H+)═c(S2-)+c(OH-) |
| D、恰好完全中和后的溶液中:c(Na+)>2c(S2-) |
查看答案和解析>>
科目: 来源: 题型:
| A、c(Na+)═c(Y-)+c(HY) |
| B、c(OH-)═c(H+)+c(HY) |
| C、c(Y-)>c(Na+)>c(OH-)>c(H+) |
| D、c(Na+)+c(H+)═c(OH-)+c(Y-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com