
科目: 来源: 题型:
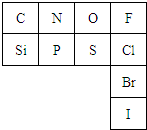 元素周期表是指导我们系统学习化学的重要工具.下表是元素周期表的一部分:
元素周期表是指导我们系统学习化学的重要工具.下表是元素周期表的一部分:查看答案和解析>>
科目: 来源: 题型:
| A | B | C | D | E |
| A、若C的最高价氧化物的水化物为强酸,则D元素肯定是活泼的非金属元素 |
| B、若A(OH)n为强碱,则B(OH)m也一定为强碱 |
| C、若C的最高正化合价为+5价,则A一定为金属元素 |
| D、若D的最低负化合价为-2价,则E的最高正价为+7价 |
查看答案和解析>>
科目: 来源: 题型:
 短周期元素X、Y、Z、W在元素周期表中的位置如图所示,Z原子最外层电子数是其电子层数的2倍,下列叙述正确的是( )
短周期元素X、Y、Z、W在元素周期表中的位置如图所示,Z原子最外层电子数是其电子层数的2倍,下列叙述正确的是( )| A、原子半径的大小顺序为:rZ>rW>rX>rY |
| B、元素W的含氧酸的酸性一定比Z的含氧酸的酸性强 |
| C、工业上是通过热还原获得元素W的单质 |
| D、XZ2和XW4中化学键的类型不同 |
查看答案和解析>>
科目: 来源: 题型:
| X | ||||||
| Y | Z | W |
| A、工业上电解YW饱和溶液冶炼金属Y |
| B、气态氢化物的稳定性:W>X |
| C、简单离子半径的大小顺序:r(Y+)>r(X-) |
| D、Y、W的最高价氧化物的水化物均能溶解金属Z |
查看答案和解析>>
科目: 来源: 题型:
| a | b | c | d | |
| e |
查看答案和解析>>
科目: 来源: 题型:
 (1)已知在25℃时:①2CO (s)+O2(g)═2CO2(g)△H1=-566KJ/mol
(1)已知在25℃时:①2CO (s)+O2(g)═2CO2(g)△H1=-566KJ/mol查看答案和解析>>
科目: 来源: 题型:
| A、0.5mol O2所含氧元素数为NA |
| B、0.2mol H2O所含的H原子数为0.2NA |
| C、0.1mol CH4所含电子数为NA |
| D、46克NO2和N2O4的混合物含有的分子数为NA |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com