
科目: 来源: 题型:
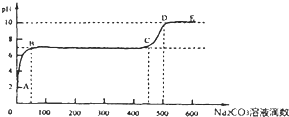
| 离子半径 | 酸性 | 还原性 | 得电子能力 |
| N3- | H2SO4 | O2- | 35Cl |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
| 实验次数 | 称取样品的质量/g | 所加Ba(OH)2溶液的体积/L | 测得生成沉淀质量/g |
| 1 | 0.858 | 0.5 | 1.379 |
| 2 | 1.716 | 0.5 | |
| 3 | 2.574 | 0.5 | 4.137 |
| 4 | 3.432 | 0.5 | 5.516 |
| 5 | 4.290 | 0.5 | 5.516 |
| 1 |
| 10 |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:

| Fe3+ | Cu2+ | Cr3+ | |
| 开始沉淀pH | 2.1 | 4.7 | 4.3 |
| 完全沉淀pH | 3.2 | 6.7 | a |
| 3 | 63 |
查看答案和解析>>
科目: 来源: 题型:
 (2,4-二甲基-1-庚烯) ②
(2,4-二甲基-1-庚烯) ②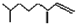 ,③CH3(CH2)2CH=CH-CH=CH(CH2)8CH3.回答下列问题:(1)的分子式
,③CH3(CH2)2CH=CH-CH=CH(CH2)8CH3.回答下列问题:(1)的分子式 ;有机物
;有机物 与M互为同分异构体,能与碳酸氢钠溶液反应放出CO2,有机物中X可能的结构有
与M互为同分异构体,能与碳酸氢钠溶液反应放出CO2,有机物中X可能的结构有查看答案和解析>>
科目: 来源: 题型:
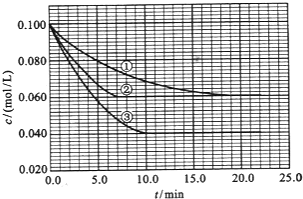
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com