
科目: 来源: 题型:

查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:

查看答案和解析>>
科目: 来源: 题型:
 如图是学校实验室从化学试剂商店买回的盐酸试剂标签上的部分内容,据此,完成下列问题:
如图是学校实验室从化学试剂商店买回的盐酸试剂标签上的部分内容,据此,完成下列问题:查看答案和解析>>
科目: 来源: 题型:
 某同学设计了测定气体摩尔体积的探究实验,利用氯酸钾分解制O2.实验步骤如下:
某同学设计了测定气体摩尔体积的探究实验,利用氯酸钾分解制O2.实验步骤如下:查看答案和解析>>
科目: 来源: 题型:
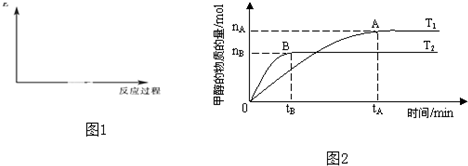
| nA |
| tA |
| C(H2O)?C(CH3OH) |
| C(CO2)?C(H2) |
| nH2 |
| nCH3OH |
查看答案和解析>>
科目: 来源: 题型:
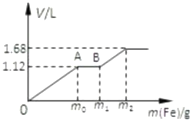 向50mL稀H2SO4与稀HNO3的混合溶液中逐渐加入铁粉,假设加入铁粉的质量与产生气体的体积(标准状况)之间的关系如图所示,且每一段只对应一个反应.
向50mL稀H2SO4与稀HNO3的混合溶液中逐渐加入铁粉,假设加入铁粉的质量与产生气体的体积(标准状况)之间的关系如图所示,且每一段只对应一个反应.查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
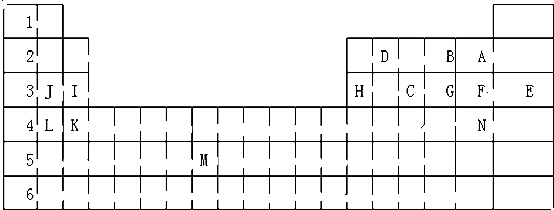
查看答案和解析>>
科目: 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com