
科目: 来源: 题型:
2- 8 |
2- 4 |
- 4 |
2- 8 |
2- 8 |
查看答案和解析>>
科目: 来源: 题型:
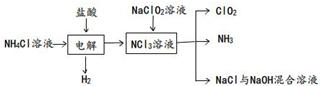
查看答案和解析>>
科目: 来源: 题型:
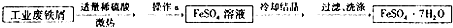
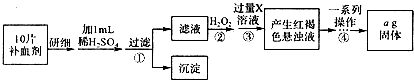
查看答案和解析>>
科目: 来源: 题型:
| >1000K |
| x |
| 2 |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
| 化学键 | A-A | B-B | A-B |
| 生成1mol化学键时放出的能量 | 436kJ?mol-1 | 243kJ?mol-1 | 431kJ?mol-1 |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
| Nutrition Facts 营养成分 500mL含量 | |
| 热量 710kJ | 碳水化合物 42g |
| 蛋白质 0g | 脂肪酸 0g |
| 维生素C 100mg | |
| 中国居民膳食营养素日推荐摄入量(RNI): 维生素C 100mg | |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com