
科目: 来源: 题型:
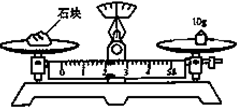 下面是用10mol/L的浓H2SO4配制成浓度为0.1mol/L的 500mL稀H2SO4的操作,请按要求填空:
下面是用10mol/L的浓H2SO4配制成浓度为0.1mol/L的 500mL稀H2SO4的操作,请按要求填空:查看答案和解析>>
科目: 来源: 题型:
| 离子 | H+ | K+ | NO3-[来源:.Com] | SO42- |
| 物质的量(mol) | 0.5 | 0.1 | 0.6 | 0.15 |
查看答案和解析>>
科目: 来源: 题型:
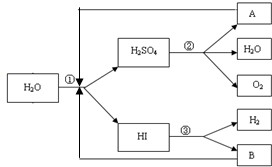 人类研究氢能源从未间断过,而热化学循环分解水制氢气是在水反应体系中加入一种中间物,经历不同的反应阶段,最终将水分解为氢气和氧气,这是一种节约能源、节省反应物料的技术,如图是一个热化学循环制氢气法的流程:
人类研究氢能源从未间断过,而热化学循环分解水制氢气是在水反应体系中加入一种中间物,经历不同的反应阶段,最终将水分解为氢气和氧气,这是一种节约能源、节省反应物料的技术,如图是一个热化学循环制氢气法的流程:查看答案和解析>>
科目: 来源: 题型:

查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
| 400℃~500℃ |
| 500℃~600℃ |
| 700℃~800℃ |

查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
| 实 验 操 作 | 答案 | 实 验 现 象 |
| (1)让一束光通过Fe(OH)3胶体 | A.棕色烟 B.生成白色胶状沉淀 C.呈现光亮的“通路” D.呈黄色 | |
| (2)向盛有AlCl3溶液的试管中加入氨水 | ||
| (3)用铂丝蘸取碳酸钠溶液,在无色火焰上灼烧,观察火焰 | ||
| (4)把红热铁丝插入盛Cl2的集气瓶中,铁丝燃烧并产生 |
查看答案和解析>>
科目: 来源: 题型:

| n(Fe) |
| n(H2SO4) |
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Cu(OH)2 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 | 4.7 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 | 6.7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com