
科目: 来源: 题型:
 如图中所涉及的物质均为中学化学中的常见物质,其中C为单质,且为空气的主要成分之一;D为黄绿色气体;E为日常生活中应用最广泛的金属单质之一,其余为化合物.它们存在如图所示的转化关系,反应中生成的次要产物均已略去.
如图中所涉及的物质均为中学化学中的常见物质,其中C为单质,且为空气的主要成分之一;D为黄绿色气体;E为日常生活中应用最广泛的金属单质之一,其余为化合物.它们存在如图所示的转化关系,反应中生成的次要产物均已略去.查看答案和解析>>
科目: 来源: 题型:

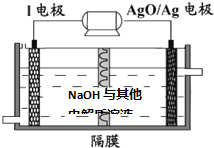
查看答案和解析>>
科目: 来源: 题型:
 利用如图所示装置制取氧气并进行相关的实验探究.
利用如图所示装置制取氧气并进行相关的实验探究.查看答案和解析>>
科目: 来源: 题型:
 在一密闭容器中发生反应N2+3H2?2NH3△H<0,达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示:
在一密闭容器中发生反应N2+3H2?2NH3△H<0,达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示:查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
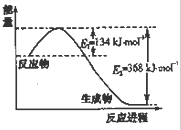
| t/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com