
科目: 来源: 题型:
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ⑥ | ⑩ | ||||||
| 3 | ① | ③ | ⑤ | ⑦ | ⑧ | ⑨ | ||
| 4 | ② | ④ |
查看答案和解析>>
科目: 来源: 题型:
| PH | 6.5~8.5 |
| Ca2+、Mg2+总浓度 | <0.0045mol/L |
| 细菌总数 | <100个/mL |
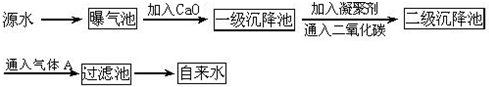
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
 有A、D、E、G、M、L六种前四周期的元素.A是宇宙中最丰富的元素.D原子核外有1个未成对电子,D+比E原子少一个电子层,E原子得一个电子填入3p轨道后,3p轨道呈全充满状态.G原子的2p轨道有2个未成对电子,M的最高化合价和最低化合价的代数和为4,与G的原子序数相差8.L位于周期表第12纵行且是六种元素中原子序数最大的.R是由M、L形成的化合物,其晶胞结构如图所示.请回答下列问题:
有A、D、E、G、M、L六种前四周期的元素.A是宇宙中最丰富的元素.D原子核外有1个未成对电子,D+比E原子少一个电子层,E原子得一个电子填入3p轨道后,3p轨道呈全充满状态.G原子的2p轨道有2个未成对电子,M的最高化合价和最低化合价的代数和为4,与G的原子序数相差8.L位于周期表第12纵行且是六种元素中原子序数最大的.R是由M、L形成的化合物,其晶胞结构如图所示.请回答下列问题:查看答案和解析>>
科目: 来源: 题型:

| 放电 |
| 充电 |
查看答案和解析>>
科目: 来源: 题型:

查看答案和解析>>
科目: 来源: 题型:
| O2 |
| ① |
| O2 |
| ② |
| H2O |
| ③ |
| Cu |
| ④ |
| BaCl2 |
| ⑤ |
查看答案和解析>>
科目: 来源: 题型:
| 压强MPa 氨的平均含量(%) 温度(摄氏度) | 0.1 | 10 | 20 | 30 | 60 | 100 |
| 200 | 15.3 | 81.5 | 86.4 | 89.9 | 95.4 | 98.8 |
| 300 | 2.2 | 52.0 | 64.2 | 71.0 | 84.2 | 92.6 |
| 400 | 0.4 | 25.1 | 38.2 | 47.0 | 65.2 | 79.8 |
| 500 | 0.1 | 10.6 | 19.1 | 26.4 | 42.2 | 57.5 |
| 600 | 0.05 | 4.5 | 9.1 | 13.8 | 23.1 | 31.4 |
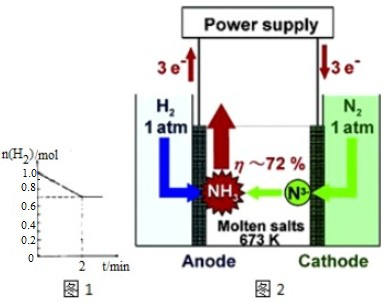
查看答案和解析>>
科目: 来源: 题型:
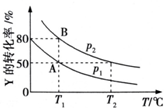 在一固定容积的密闭容器中加入X、Y、Z三种气体,保持一定温度,不同时刻测得X、Y、Z三种物质的物质的量如表所示.
在一固定容积的密闭容器中加入X、Y、Z三种气体,保持一定温度,不同时刻测得X、Y、Z三种物质的物质的量如表所示.| 测定时间/s | t1 | t2 | t3 | t4 |
| n(X)/mol | 7 | 3 | 1 | 1 |
| n(Y)/mol | 5 | 3 | 2 | 2 |
| n(Z)/mol | 1 | 3 | 4 | 4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com