
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
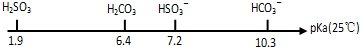
查看答案和解析>>
科目: 来源: 题型:
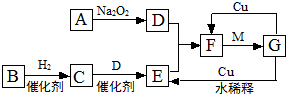
查看答案和解析>>
科目: 来源: 题型:
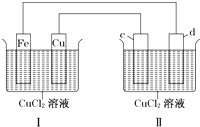 下列装置可实现电解CuCl2溶液,c、d均为石墨.读图回答下列问题:
下列装置可实现电解CuCl2溶液,c、d均为石墨.读图回答下列问题:查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
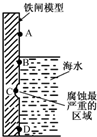 铁及其化合物与生产、生活关系密切.
铁及其化合物与生产、生活关系密切.查看答案和解析>>
科目: 来源: 题型:
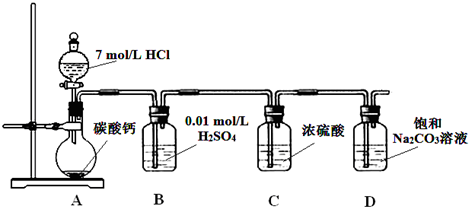
查看答案和解析>>
科目: 来源: 题型:
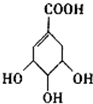 2013年4月1日,一场突如其来的H7N9(禽流感)袭击我国,闹得全国人民人心惶惶,在中国传统的香料和中药八角茴香含有一种重要成分莽草酸,莽草酸是目前世界上被证明是对抗禽流感的最佳良方--“达菲”的原材料.莽草酸的结构简式如图所示
2013年4月1日,一场突如其来的H7N9(禽流感)袭击我国,闹得全国人民人心惶惶,在中国传统的香料和中药八角茴香含有一种重要成分莽草酸,莽草酸是目前世界上被证明是对抗禽流感的最佳良方--“达菲”的原材料.莽草酸的结构简式如图所示查看答案和解析>>
科目: 来源: 题型:
| 浓度/mol?L-1 时间/min | NO | N2 | CO2 |
| 0 | 0.100 | 0 | 0 |
| 10 | 0.058 | 0.021 | 0.021 |
| 20 | 0.050 | 0.025 | 0.025 |
| 30 | 0.050 | 0.025 | 0.025 |
| 40 | 0.036 | 0.032 | 0.010 |
| 50 | 0.036 | 0.032 | 0.010 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com