
科目: 来源: 题型:

| ||
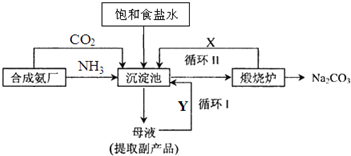
查看答案和解析>>
科目: 来源: 题型:
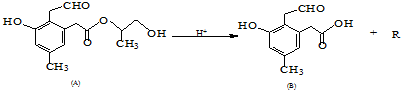
查看答案和解析>>
科目: 来源: 题型:
 甲、乙两个探究性学习小组,拟在实验室中通过铝与足量的稀硫酸反应生成的氢气来测定铝的摩尔质量.
甲、乙两个探究性学习小组,拟在实验室中通过铝与足量的稀硫酸反应生成的氢气来测定铝的摩尔质量.| 实验前 | 实验后 | |
| 铝铜合金质量/g | m1 | m2 |
| 量液管(C)液面读数/mL | V1 | V2 |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
| A、K+、Al3+、F-、NO2- |
| B、NO2-、CrO42-、H+、Fe2+ |
| C、Mg2+、Al3+、CH2COO-、SO42- |
| D、Al3+、Na+、AlO2-、SO42- |
查看答案和解析>>
科目: 来源: 题型:
| A、BF3是三角锥形分子 | ||
B、NH
 ,离子呈平面形结构 ,离子呈平面形结构 | ||
| C、CH4分子中的4个C-H键都是氢原子的1s轨道与碳原子的p轨道形成的s-p σ键 | ||
| D、CH4分子中的碳原子以4个sp3杂化轨道分别与4个氢原子的1s轨道重叠,形成4个s-sp3σ键 |
查看答案和解析>>
科目: 来源: 题型:
| 容器 | 物质 | 起始浓度/(mol?L-1 | 平衡浓度/(mol?L-1 |
| Ⅰ | N2O4 | 0.100 | 0.040 |
| NO2 | 0 | 0.120 | |
| Ⅱ | N2O4 | 0 | 0.014 |
| NO2 | 0.100 | 0.072 |
| A、平衡后,分别压缩容器Ⅰ、Ⅱ,则Ⅰ、Ⅱ中气体颜色都将变深 |
| B、平衡时,Ⅰ、Ⅱ中反应物的转化率a(N2O4)<a(NO2) |
| C、平衡时,Ⅰ、Ⅱ中反应的平衡常数K(Ⅰ)═2K(Ⅱ) |
| D、平衡后,升高相同温度,以N2O4表示的反应速率v(Ⅰ)<v(Ⅱ) |
查看答案和解析>>
科目: 来源: 题型:
| A、为得到较大的晶体颗粒,结晶时通常采用浓度较低,溶剂蒸发速度较慢或溶液冷却较慢的条件 |
| B、纸层析中,滤纸作为固定相,展开剂作为流动相 |
| C、过滤、结晶、灼烧、萃取、分液和蒸馏等都是常用的分离有机混合物的方法 |
| D、用硝酸银溶液可以鉴别NaCl溶液和NaNO2溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com