
科目: 来源: 题型:
| ||
查看答案和解析>>
科目: 来源: 题型:
| 干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色K2FeO4和KNO2等产物 |
| 湿法 | 强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色Na2FeO4溶液 |
| ||
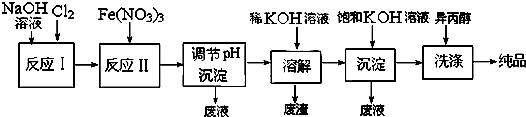
查看答案和解析>>
科目: 来源: 题型:
 科学家一直致力于“人工固氮”的方法研究.合成氨的原理为:N2(g)+3H2(g)?2NH3(g),该反应的能量变化如图所示.
科学家一直致力于“人工固氮”的方法研究.合成氨的原理为:N2(g)+3H2(g)?2NH3(g),该反应的能量变化如图所示.查看答案和解析>>
科目: 来源: 题型:
| 实验序号 | Ⅰ | Ⅱ | Ⅲ |
| 滴加溶液A的体积/mL | 5.0 | 10.0 | 15.0 |
| 生成气体的体积/mL(标准状况) | 44.8 | 89.6 | 112 |
查看答案和解析>>
科目: 来源: 题型:
| CH4 | C2H6 | CO32- | C2O42- | ||
| NH4+ | N2H62+ | NO2+ | N2O4 |
查看答案和解析>>
科目: 来源: 题型:
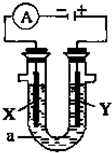 (1)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是
(1)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是查看答案和解析>>
科目: 来源: 题型:
 某研究性学习小组用电解CuSO4溶液的方法测定铜的相对原子质量(装置如图),实验中测得某电极的质量增重为m g,已知氧元素相对原子质量为16.请回答:
某研究性学习小组用电解CuSO4溶液的方法测定铜的相对原子质量(装置如图),实验中测得某电极的质量增重为m g,已知氧元素相对原子质量为16.请回答:查看答案和解析>>
科目: 来源: 题型:
 ⑦O2和O3 ⑧CH3CH(CH3)CH3和CH(CH3)3 ⑨金刚石和石墨.
⑦O2和O3 ⑧CH3CH(CH3)CH3和CH(CH3)3 ⑨金刚石和石墨.查看答案和解析>>
科目: 来源: 题型:
 (1)如图所示装置,回答下列问题盐桥中阴离子移向
(1)如图所示装置,回答下列问题盐桥中阴离子移向
| ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com