
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
 A、B、C、D为短周期元素,A元素的原子价电子排布为ns2np2,B元素原子的最外层子数是其电子层数的3倍,C元素原子的M能层的p能级有3个未成对电子,D元素原子核外的M能层中只有2对成对电子.请回答下列问题:
A、B、C、D为短周期元素,A元素的原子价电子排布为ns2np2,B元素原子的最外层子数是其电子层数的3倍,C元素原子的M能层的p能级有3个未成对电子,D元素原子核外的M能层中只有2对成对电子.请回答下列问题:查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
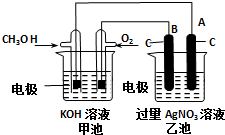 某实验小组依据甲醇燃烧的反应原理,设计如图所示的装置.已知甲池的总反应式为:2CH3OH+3O2+4KOH=2K2CO3+6H2O.请回答:
某实验小组依据甲醇燃烧的反应原理,设计如图所示的装置.已知甲池的总反应式为:2CH3OH+3O2+4KOH=2K2CO3+6H2O.请回答:查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
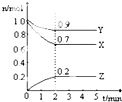 I、某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:
I、某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com