
科目: 来源: 题型:


查看答案和解析>>
科目: 来源: 题型:
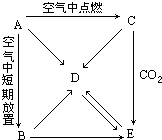 A、B、C、D、E五中物质都含有同一种元素,它们按图所示的关系相互转化,已知A为单质,C为一种淡黄色的固体,
A、B、C、D、E五中物质都含有同一种元素,它们按图所示的关系相互转化,已知A为单质,C为一种淡黄色的固体,查看答案和解析>>
科目: 来源: 题型:
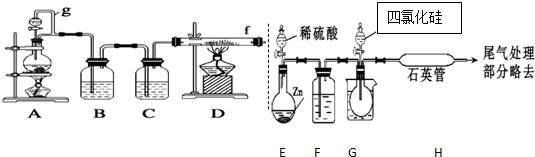
| 物质 | SiCl4 | BCl3 | AlCl3 | FeCl3 | PCl5 |
| 沸点/℃ | 57.7 | 12.8 | - | 315 | - |
| 熔点/℃ | -70.0 | -107.2 | - | - | - |
| 升华温度/℃ | - | - | 180 | 300 | 162 |
查看答案和解析>>
科目: 来源: 题型:
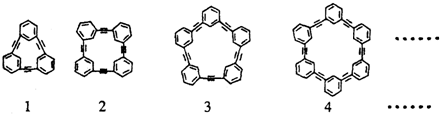
查看答案和解析>>
科目: 来源: 题型:
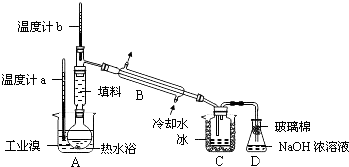
查看答案和解析>>
科目: 来源: 题型:
| 实验步骤 | 所需仪器 |
| 1. | 烧杯、玻璃棒 |
| 2.向溶液中滴加Na2CO3溶液至 | 烧杯、 |
| 3. | 铁架台、玻璃棒、烧杯、 |
| 4.滴加 | |
| 5. | 三脚架、玻璃棒、 |
查看答案和解析>>
科目: 来源: 题型:
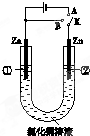 在一个U形管里盛有氯化铜溶液,并插入两块锌片作电极,按图连接.
在一个U形管里盛有氯化铜溶液,并插入两块锌片作电极,按图连接.查看答案和解析>>
科目: 来源: 题型:

查看答案和解析>>
科目: 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com