
科目: 来源: 题型:
| A、0.5mol/L NaCl溶液 |
| B、0.3mol/L Na2SO4溶液 |
| C、0.4mol/L Na2CO3溶液 |
| D、0.15mol/L Na3PO4溶液 |
查看答案和解析>>
科目: 来源: 题型:
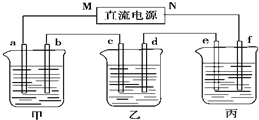
查看答案和解析>>
科目: 来源: 题型:

查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:

| 放电 |
| 充电 |
查看答案和解析>>
科目: 来源: 题型:
 I、根据如图回答
I、根据如图回答 2SO3反应,
2SO3反应,查看答案和解析>>
科目: 来源: 题型:
| 元素代号 | Q | R | X | Z |
| 微粒信息 | 离子 | 单质分子 R2 | 离子: X3+ | 一种原子 816Z |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com