
科目: 来源: 题型:
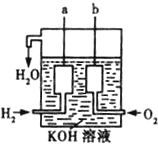 氢气燃烧生成液态水的热化学方程式是2H2(g)+O2(g)═2H2O(l);△H=-572kJ/mol请回答下列问题:
氢气燃烧生成液态水的热化学方程式是2H2(g)+O2(g)═2H2O(l);△H=-572kJ/mol请回答下列问题:查看答案和解析>>
科目: 来源: 题型:
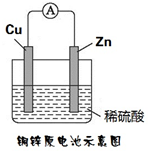 如图所示,将锌、铜通过导线相连,置于稀硫酸中.
如图所示,将锌、铜通过导线相连,置于稀硫酸中.查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
 如图是某食品调味有限公司生产的XX牌白醋标签部分内容,某学校学生兴趣小组为了检验该品牌白醋中的醋酸(CH3COOH)含量,进行下列实验:(小数点后保留1位有效数字)
如图是某食品调味有限公司生产的XX牌白醋标签部分内容,某学校学生兴趣小组为了检验该品牌白醋中的醋酸(CH3COOH)含量,进行下列实验:(小数点后保留1位有效数字) 查看答案和解析>>
科目: 来源: 题型:
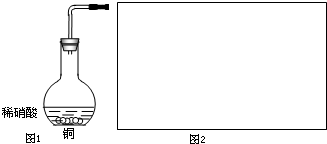 I.工业上用洗净的废铜屑作原料来制备硝酸铜.为了节约原料和防止污染环境,宜采取的方法是
I.工业上用洗净的废铜屑作原料来制备硝酸铜.为了节约原料和防止污染环境,宜采取的方法是| 空气 |
| △ |
| 浓硝酸 |
| 浓硫酸 |
| Ba(NO3)2 |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
| 温度/℃ | 1538 | 1760 | 2404 |
| 平衡常数定 | 0.86×10-4 | 2.6×10-4 | 64×10-4 |
| 时间/min | N2(mol?L-1) | 02(mol?L-1) | NO(mol?L-1) |
| 0 | 2.60 | 2.60 | 0 |
| 2 | 2.54 | 2.54 | 0.12 |
| 3 | c1 | c2 | c3 |
| 4 | c1 | c2 | c3 |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
 能源是国民经济发展的重要基础.
能源是国民经济发展的重要基础.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com