
科目: 来源: 题型:
| 配料表 | 精制海盐、碘酸钾(KIO3) |
| 含碘 | 35mg/kg |
| 储藏方法 | 密封避光、防潮 |
| 使用方法 | 烹调时待食品熟后加入碘盐 |
查看答案和解析>>
科目: 来源: 题型:
| ||
| ||
| ||
| ||
查看答案和解析>>
科目: 来源: 题型:
| 1 |
| 2 |
| 化学键 | 键能(kJmol) | 化学键 | 键能(kJmol) |
| NN | 942 | H-O | 460 |
| N-N | 391 | 0=0 | 499 |
| H-H | 437 |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
| 温度/℃ | 200 | 250 | 300 | 350 |
| 平衡常数K | 9.94 | 5.2 | 1 | 0.5 |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
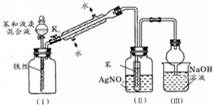 如图是苯与溴发生反应并进行产物检验的反应装置,具体实验过程如下:
如图是苯与溴发生反应并进行产物检验的反应装置,具体实验过程如下:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com