
科目: 来源: 题型:

查看答案和解析>>
科目: 来源: 题型:

| 试剂 | KOH | NaOH | Ca(OH)2 |
| 价格(元/吨) | 6800 | 3200 | 1200 |
| △ |
| C或H2或CO |
| △ |
| △ |
| 电解 |
| 熔融 |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
| 高温 |
| 温度 | 25℃~550℃~600℃~700℃ |
| 主要成分 | WO3 W2O5 WO2 W |
| 1400℃ |
| 约3000℃ |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
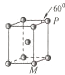 X、Y、Z、W、Q五种元素其核电荷数依次增大.X原子只有1个s电子,Y、Z、W属于同周期,Y原子L层中s电子和p电子数目相同,Z原子p轨道为半充满,W原子第一电离能比Z原子的小,Q原子内层均饱和,N层上只有两个电子.
X、Y、Z、W、Q五种元素其核电荷数依次增大.X原子只有1个s电子,Y、Z、W属于同周期,Y原子L层中s电子和p电子数目相同,Z原子p轨道为半充满,W原子第一电离能比Z原子的小,Q原子内层均饱和,N层上只有两个电子.查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com