
科目: 来源: 题型:
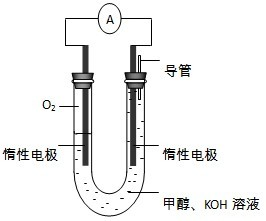 能源短缺是人类社会面临的重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景.
能源短缺是人类社会面临的重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景.查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
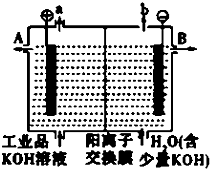 锌银电池能量大、电压平稳,广泛用于电子手表、照相机、计算器和其他微型电子仪器.电解质溶液是KOH溶液,电池总反应为Zn+Ag2O═ZnO+2Ag.请回答下列问题:
锌银电池能量大、电压平稳,广泛用于电子手表、照相机、计算器和其他微型电子仪器.电解质溶液是KOH溶液,电池总反应为Zn+Ag2O═ZnO+2Ag.请回答下列问题:
| ||
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
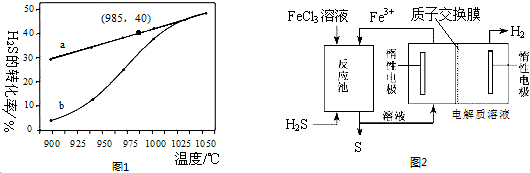
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com