
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
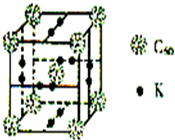 碳、氢、氟、氮、硅等非金属元素与人类的生产生活息息相关.回答下列问题:
碳、氢、氟、氮、硅等非金属元素与人类的生产生活息息相关.回答下列问题:查看答案和解析>>
科目: 来源: 题型:
| 物质 | 活性炭 | NO | E | F |
| n/mol | ||||
| T/℃ | ||||
| 初始 | 2.030 | 0.100 | 0 | 0 |
| T1 | 2.000 | 0.040 | 0.030 | 0.030 |
| T2 | 2.005 | 0.050 | 0.025 | 0.025 |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
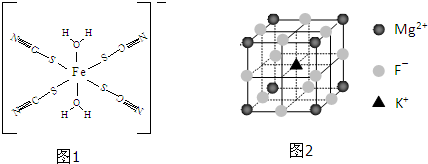
查看答案和解析>>
科目: 来源: 题型:
| 元素符号 | Li | Be | B | C | O | F | Na | Al | Si | P | S | Cl |
| x值 | 0.98 | 1.57 | 2.04 | 2.55 | 3.44 | 3.98 | 0.93 | 1.61 | 1.90 | 2.19 | 2.58 | 3.16 |
查看答案和解析>>
科目: 来源: 题型:
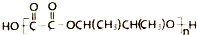 的合成路线流程图(无机试剂任用).合成路线流程图如图:
的合成路线流程图(无机试剂任用).合成路线流程图如图: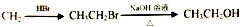
查看答案和解析>>
科目: 来源: 题型:
| X | |||
| W | Y | R | |
| Z | |||
| A、常温常压下,五种元素对应的单质中有两种是气态 |
| B、Y元素最高价氧化物对应水化物的酸性比W元素的弱 |
| C、Y、Z的阴离子电子层结构都与R原子的相同 |
| D、W的氢化物比X的氢化物稳定 |
查看答案和解析>>
科目: 来源: 题型:
| A、强酸性溶液中:K+、S2-、ClO-、SO42- |
| B、含有0.1mol?L-1 Fe3+的溶液中:K+、Mg2+、I-、NO3- |
| C、室温下,pH=1的溶液中:Na+、Fe3+、NO3-、SO42- |
| D、加入Al能放出H2的溶液中::Na+、K+、CO32-、Cu2+ |
查看答案和解析>>
科目: 来源: 题型:
| A、7.8g Na2O2所含的阴离子数目为2NA |
| B、在熔融状态下,lmol KHSO4完全电离出的阳离子数目为2NA |
| C、14g乙烯和丙烯的混和气体中共含有3NA对共用电子对 |
| D、将分子总数为NA的NH3和HCl的混合气体置于标准状况下,其体积为约22.4L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com