
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
| ||
| 充电 |
查看答案和解析>>
科目: 来源: 题型:
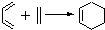 .
.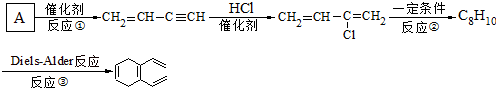
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
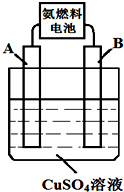 以氨气代替氢气研发氨燃料电池是当前科研的一个热点.
以氨气代替氢气研发氨燃料电池是当前科研的一个热点.查看答案和解析>>
科目: 来源: 题型:
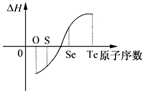 某化学兴趣小组专门研究了氧族元素及其某些化合物的部分性质.所查资料信息如下:
某化学兴趣小组专门研究了氧族元素及其某些化合物的部分性质.所查资料信息如下:查看答案和解析>>
科目: 来源: 题型:
| 酸 | 电离方程式 | 电离常数 K/mol?L-1 |
| CH3COOH | CH3COOH?CH3COO-+H+ | 1.26×10-5 |
| H2CO3 | H2CO3?H++HCO3- HCO3-?CO32-+H+ | K1=4.31×10-7 K2=5.61×10-11 |
| H2S | H2S?H++HS- HS-?H++S2- | K1=9.1×10-8 K2=1.1×10-12 |
| H3PO4 | H3PO4?H++H2PO4- H2PO4-?H++HPO42- HPO42-?H++PO43- | K1=7.52×10-3 K2=6.23×10-8 K3=2.20×10-13 |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com