
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
 现有含NH4+、H+、Al3+、Mg2+、Cl-的溶液100mL,往其中逐滴加入2mol/L的氢氧化钠溶液,并不断搅拌,所得沉淀质量与所加氢氧化钠溶液体积的关系如图,其中OA段无气体产生,回答下列问题.
现有含NH4+、H+、Al3+、Mg2+、Cl-的溶液100mL,往其中逐滴加入2mol/L的氢氧化钠溶液,并不断搅拌,所得沉淀质量与所加氢氧化钠溶液体积的关系如图,其中OA段无气体产生,回答下列问题.查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
| 实验步骤 | 解释或实验结论 |
| (1)称取A 9.0g,升温使其汽化,测其密度是相同条件下H2的45倍. | 试通过计算填空: (1)A的相对分子质量为: |
| (2)将此9.0g A在足量纯O2中充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重5.4g和13.2g | (2)A的分子式为: |
| (3)另取A 9.0g,跟足量的NaHCO3粉末反应,生成2.24L CO2(标准状况),若与足量金属钠反应则生成2.24L H2(标准状况) | (3)A中官能团的结构简式: |
(4)A的核磁共振氢谱如图: | (4)A中含有 |
| (5)综上所述,A的结构简式 A与浓H2SO4混合,在一定条件下反应生成六元环状物B,B的结构简式 | |
查看答案和解析>>
科目: 来源: 题型:
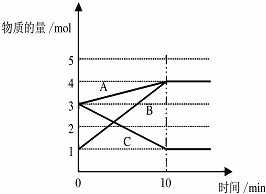 (1)将一定量的A、B、C三种物质(都是气体)放入固定体积为10L的密闭容器中,一定条件下发生反应,一段时间内测得各物质的物质的量变化如图所示.
(1)将一定量的A、B、C三种物质(都是气体)放入固定体积为10L的密闭容器中,一定条件下发生反应,一段时间内测得各物质的物质的量变化如图所示.| 实验 序号 | 浓度 | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| 1 | 800℃ | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
| 2 | 800℃ | 1.0 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
| 3 | 800℃ | C3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
| 4 | 820℃ | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
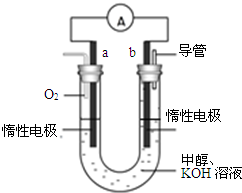 甲醇来源丰富.价格低廉.运输贮存方便,是一种重要的化工原料,有着重要的用途和应用前景.
甲醇来源丰富.价格低廉.运输贮存方便,是一种重要的化工原料,有着重要的用途和应用前景.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com