
科目: 来源: 题型:
| 15 |
| 16 |
查看答案和解析>>
科目: 来源: 题型:
| 方案 | 反应物 |
| 甲 | Cu、浓HNO3 |
| 乙 | Cu、稀HNO3 |
| 丙 | Cu、O2、稀HNO3 |
查看答案和解析>>
科目: 来源: 题型:

查看答案和解析>>
科目: 来源: 题型:
| CH3CH2CHO |
| KOH① |
| 浓H2SO4 |
| △② |
| H2.Ni |
| ③ |
| O2 |
| Cu.△④ |
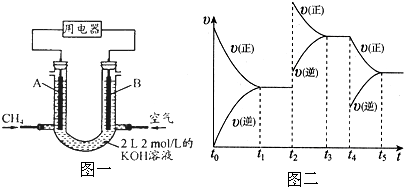
| KOH |
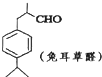
 可写成
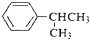
可写成
查看答案和解析>>
科目: 来源: 题型:
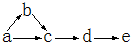 a、b、c、d、e是含有一种相同元素的五种物质,可发生如右图所示的转化.其中:a是单质;c、d是氧化物;e是最高价氧化物对应的水化物.
a、b、c、d、e是含有一种相同元素的五种物质,可发生如右图所示的转化.其中:a是单质;c、d是氧化物;e是最高价氧化物对应的水化物.查看答案和解析>>
科目: 来源: 题型:
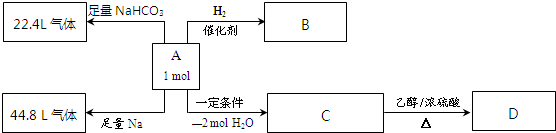
查看答案和解析>>
科目: 来源: 题型:
| 加入NaOH溶液的体积 | pH | |
| ① | 0L | 2 |
| ② | 1L | 4 |
| ③ | 2L | 10 |
| ④ | 3L | 12 |
| c(Na+) | ||
c(P
|
查看答案和解析>>
科目: 来源: 题型:
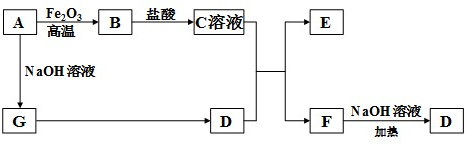
查看答案和解析>>
科目: 来源: 题型:
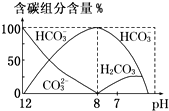 在含有弱电解质的溶液中,往往有多个化学平衡共存.
在含有弱电解质的溶液中,往往有多个化学平衡共存.| c(CH3COO-)?c(H+) |
| c(CH3COOH) |
c(HC
| ||
c(C
|
查看答案和解析>>
科目: 来源: 题型:
| 催化剂 |


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com