
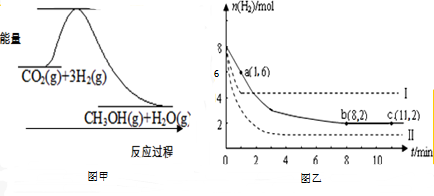
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
| 实验步骤 | 预期现象与结论 |
| 步骤1:取2mL FeSO4溶液和2mL KI溶液混合于试管中,再滴加1~2滴氯水. | 现象:溶液变成黄色. 结论: |
| 步骤2: | 现象: 结论: |
查看答案和解析>>
科目: 来源: 题型:
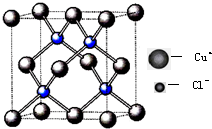 利用反应:Cu2Cl2+C2H2+2NH3→Cu2C2(乙炔亚铜,红色)+2NH4Cl可检验乙炔.
利用反应:Cu2Cl2+C2H2+2NH3→Cu2C2(乙炔亚铜,红色)+2NH4Cl可检验乙炔.查看答案和解析>>
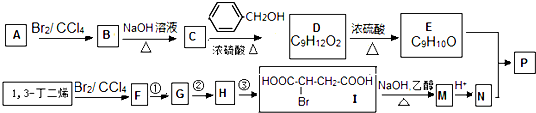
科目: 来源: 题型:
| KMnO4/H+ |
| 浓H2SO4 |
| △ |
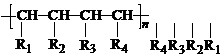 nCH=CH+nCH=CH
nCH=CH+nCH=CH| 催化剂 |
查看答案和解析>>
科目: 来源: 题型:
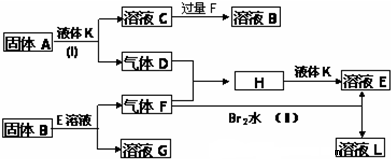
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
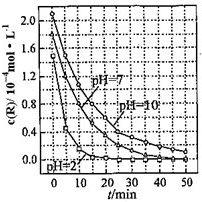 一定条件下,溶液的酸碱性对TiO2光催化燃料R降解反应的影响如图所示.请回答下列问题:
一定条件下,溶液的酸碱性对TiO2光催化燃料R降解反应的影响如图所示.请回答下列问题:查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com