
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
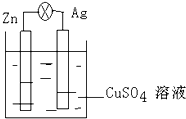 如图所示,在银锌原电池中,以硫酸铜为电解质溶液,锌为
如图所示,在银锌原电池中,以硫酸铜为电解质溶液,锌为查看答案和解析>>
科目: 来源: 题型:
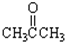 ;③CH3CH2Br;④
;③CH3CH2Br;④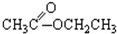 ;⑤
;⑤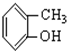 ;⑥
;⑥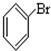 ;⑦
;⑦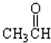 ;⑧
;⑧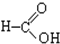 ;⑨
;⑨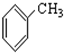 ;⑩
;⑩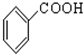
查看答案和解析>>
科目: 来源: 题型:
| 实验要求 | 化学试剂 |
| 检验酒精中是否有水 | |
| 区别CH4和C2H4两种无色气体 | |
| 证明马铃薯中含淀粉 | |
| 除去Fe2O3中的Al2O3 |
| 实验目的 | 实验方法 |
| 除去Na2C03固体中少量的NaHC03 | |
| 检验自来水中是否含有Cl- | |
| 证明NaOH溶液呈碱性 | |
| 除去FeCl2溶液中少量的FeCl3 |
查看答案和解析>>
科目: 来源: 题型:
| 化学键 | Si-O | O=O | Si-Si |
| 键能(kJ?mol-1) | 460 | 498 | 226 |
查看答案和解析>>
科目: 来源: 题型:
| I1/kJ?mol-1 | I2/kJ?mol-1 | I3/kJ?mol-1 | I4/kJ?mol-1 | I5/kJ?mol-1 |
| 738 | 1451 | 7733 | 10540 | 13630 |
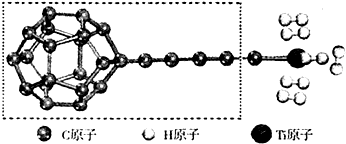
查看答案和解析>>
科目: 来源: 题型:

| 1 |
| 20 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com