
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
| 9.4 |
| c(H+)c(CH3COO-) |
| c(CH3COOH) |
| 17.5 |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
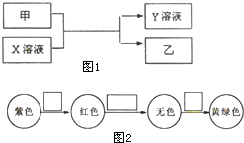 甲、乙是同主族非金属元素组成的单质,乙通常状况下是深红棕色液体.X、Y是化合物.X溶液呈淡绿色.它们之间有如图1所示转化关系.
甲、乙是同主族非金属元素组成的单质,乙通常状况下是深红棕色液体.X、Y是化合物.X溶液呈淡绿色.它们之间有如图1所示转化关系.查看答案和解析>>
科目: 来源: 题型:
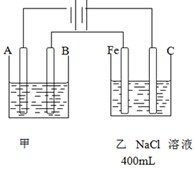 如图为相互串联的甲乙两个电解池,请回答:
如图为相互串联的甲乙两个电解池,请回答:查看答案和解析>>
科目: 来源: 题型:
 与
与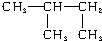 ④O2和O3 ⑤氯水和氯气
④O2和O3 ⑤氯水和氯气查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
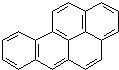 露天烧烤不仅产生大量有害气体污染环境,而且在烧焦的肉类中还含有强烈的致癌物:苯并芘,其结构简式如图:
露天烧烤不仅产生大量有害气体污染环境,而且在烧焦的肉类中还含有强烈的致癌物:苯并芘,其结构简式如图:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com