
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
 我国濒临海域的省份,能够充分利用海水制得多种化工产品.如图是以海水、贝壳(主要成分CaCO3)等为原料制取几种化工产品的工艺流程图,其中固体B是生活中的一种必需品,E是一种化肥,N是一种常见的金属单质.
我国濒临海域的省份,能够充分利用海水制得多种化工产品.如图是以海水、贝壳(主要成分CaCO3)等为原料制取几种化工产品的工艺流程图,其中固体B是生活中的一种必需品,E是一种化肥,N是一种常见的金属单质.查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
 (1)过渡金属元素有很多不同于主族元素的性质,如能形成多种配合物,如:Fe(CO)x、[Fe(H2NCONH2)6](NO3)3[三硝酸六尿素合铁(Ⅲ)]、[Cu(NH3)4]SO4等.
(1)过渡金属元素有很多不同于主族元素的性质,如能形成多种配合物,如:Fe(CO)x、[Fe(H2NCONH2)6](NO3)3[三硝酸六尿素合铁(Ⅲ)]、[Cu(NH3)4]SO4等.查看答案和解析>>
科目: 来源: 题型:
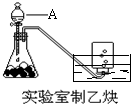 实验室制取乙炔的实验装置图(如图)中,
实验室制取乙炔的实验装置图(如图)中,查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
 X、Y、Z为三种短周期元素,原子序数之和为32,X和Y为相邻周期的元素,Y和Z为同周期的元素.Y的质子数比X多5个,X的最外层电子数为Y最外层电子数的2倍,X的最外层电子数和Z的最外层电子数之和为7;W+中所有电子正好充满K、L、M三个电子层.
X、Y、Z为三种短周期元素,原子序数之和为32,X和Y为相邻周期的元素,Y和Z为同周期的元素.Y的质子数比X多5个,X的最外层电子数为Y最外层电子数的2倍,X的最外层电子数和Z的最外层电子数之和为7;W+中所有电子正好充满K、L、M三个电子层.查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com