
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
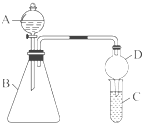 某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.
某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.查看答案和解析>>
科目: 来源: 题型:
 人类在使用金属的历史进程中,经历了铜、铁、铝之后,第四种将被广泛应用的金属则被科学家预测为是钛(Ti).钛外观似钢,具有银灰光泽.钛的特性是强度大,密度小(4.51g/cm3),硬度大,熔点高(1675℃),自1791年英国牧师格列高尔发现钛至今,钛和钛的合金已被广泛用于制造飞机、火箭、卫星、宇宙飞船、舰艇、汽轮机、化工设备、电讯器材、人造骨骼等,被誉为“未来世纪的金属”.试回答下列问题:
人类在使用金属的历史进程中,经历了铜、铁、铝之后,第四种将被广泛应用的金属则被科学家预测为是钛(Ti).钛外观似钢,具有银灰光泽.钛的特性是强度大,密度小(4.51g/cm3),硬度大,熔点高(1675℃),自1791年英国牧师格列高尔发现钛至今,钛和钛的合金已被广泛用于制造飞机、火箭、卫星、宇宙飞船、舰艇、汽轮机、化工设备、电讯器材、人造骨骼等,被誉为“未来世纪的金属”.试回答下列问题:| 2 |
| 3 |
查看答案和解析>>
科目: 来源: 题型:
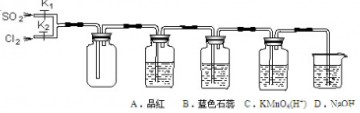
查看答案和解析>>
科目: 来源: 题型:
 研究控制汽车尾气成为保护环境的重要任务.汽车内燃机工作时发生反应:
研究控制汽车尾气成为保护环境的重要任务.汽车内燃机工作时发生反应:| 温度(℃) | c(氨水)(mol/L) | 电离常数 | 电离度(%) | c(OH-)(mol/L) |
| 0 | 16.56 | 1.37×10-5 | 9.098 | 1.507×10-2 |
| 10 | 15.16 | 1.57×10-5 | 10.18 | 1.543×10-2 |
| 20 | 13.63 | 1.71×10-5 | 11.2 | 1.527×10-2 |
查看答案和解析>>
科目: 来源: 题型:
 A、B、C、D、F是常见的化合物,其中F在常温下是一种无色液体,D为强酸,请根据如图转化关系(反应条件及部分产物已略去),回答下列问题:
A、B、C、D、F是常见的化合物,其中F在常温下是一种无色液体,D为强酸,请根据如图转化关系(反应条件及部分产物已略去),回答下列问题:查看答案和解析>>
科目: 来源: 题型:
| A、1mol N2的质量是14g |
| B、H2SO4的摩尔质量是98g |
| C、H2O的摩尔质量是18g/mol |
| D、1mol HCl的质量是36.5g/mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com