
科目: 来源: 题型:
| 化学键 | C-H | C=C | C-C | H-H |
| 键能/kJ?mol-1 | 414.4 | 615.3 | 347.4 | 435.3 |
查看答案和解析>>
科目: 来源: 题型:
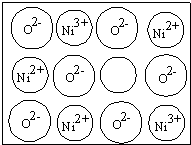 超细氧化镍(NiO)是一种功能材料,已被广泛用于电池电极、催化剂、半导体、玻璃染色剂等方面.工业上常以Ni(NO3)2?6H2O和尿素[CO(NH2)2]为原料制备.
超细氧化镍(NiO)是一种功能材料,已被广泛用于电池电极、催化剂、半导体、玻璃染色剂等方面.工业上常以Ni(NO3)2?6H2O和尿素[CO(NH2)2]为原料制备.查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
| 序号 | 第一组 | 第二组 | 第三组 | 第四组 |
| t/℃ | 30 | 40 | 50 | 80 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 | 2.0 |
查看答案和解析>>
科目: 来源: 题型:
| 仪器 |  |
 |
 |
 |
| 名称 |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
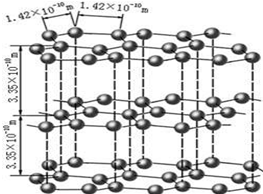

查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com