
科目: 来源: 题型:
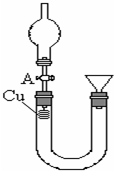 某研究性学习小组设计实验方案(见图)研究稀硝酸与铜反应生成NO.
某研究性学习小组设计实验方案(见图)研究稀硝酸与铜反应生成NO.查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
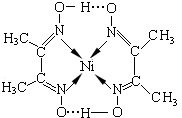
 决定物质性质的重要因素是物质结构.请回答下列问题:
决定物质性质的重要因素是物质结构.请回答下列问题:| 氟化物 | NaF | MgF2 | SiF4 |
| 熔点/K | 1266 | 1534 | 183 |
| C-O | C=O | C≡O | |
| CO | 357.7 | 798.9 | 1071.9 |
| N-N | N=N | N≡N | |
| N2 | 154.8 | 418.4 | 941.7 |
| 电离能/kJ?mol-1 | I1 | I2 | I3 | I4 |
| A | 578 | 1817 | 2745 | 11578 |
| B | 738 | 1451 | 7733 | 10540 |
查看答案和解析>>
科目: 来源: 题型:
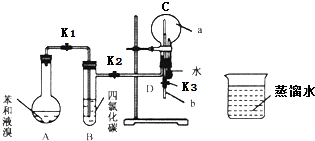 德国化学家凯库勒认为苯分子的结构中,碳碳间以单、双键交替结合而成环状.为了评价凯库勒的观点,某学生设计了以下实验方案:
德国化学家凯库勒认为苯分子的结构中,碳碳间以单、双键交替结合而成环状.为了评价凯库勒的观点,某学生设计了以下实验方案:查看答案和解析>>
科目: 来源: 题型:
| 化学键 | C-H | C-F | H-F | F-F |
| 键能 | 414 | 489 | 565 | 158 |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
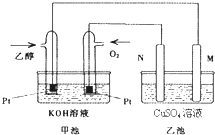 与甲醇燃料电池相比,乙醇燃料电池具有毒性低、理论能量密度高等优点,因此被广泛认为是更有前途的燃料电池.如图是一个乙醇燃料电池工作时的示意图.乙池中的两个电极均为石墨电极,乙池中盛有100mL 3.00mol/L的CuSO4溶液.请回答下列问题:
与甲醇燃料电池相比,乙醇燃料电池具有毒性低、理论能量密度高等优点,因此被广泛认为是更有前途的燃料电池.如图是一个乙醇燃料电池工作时的示意图.乙池中的两个电极均为石墨电极,乙池中盛有100mL 3.00mol/L的CuSO4溶液.请回答下列问题:查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
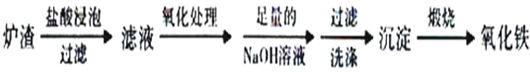
查看答案和解析>>
科目: 来源: 题型:
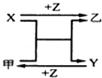 X、Y、Z三种常见元素的单质,甲、乙是两种常见的化合物,相互间有如图转化关系.回答下列问题:
X、Y、Z三种常见元素的单质,甲、乙是两种常见的化合物,相互间有如图转化关系.回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com