
科目: 来源: 题型:
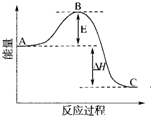 2SO2(g)+O2(g)?2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ?mol-1.
2SO2(g)+O2(g)?2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ?mol-1.查看答案和解析>>
科目: 来源: 题型:
 【化学--进修3:物质结构与性质】
【化学--进修3:物质结构与性质】查看答案和解析>>
科目: 来源: 题型:
| 0.01mol?L-1KIO3酸性溶液(含淀粉)的体积/mL | 0.01mol?L-1Na2SO3溶液的体积/mL | H2O的体积/mL | 实验温度 /℃ |
溶液出现蓝色时所需时间/s | |
| 实验1 | 5 | V1 | 35 | 25 | |
| 实验2 | 5 | 5 | 40 | 25 | |
| 实验3 | 5 | 5 | V2 | 0 |
查看答案和解析>>
科目: 来源: 题型:
| 化学键 | C=C | C-C | C-H | C-O | O-H |
| 断开键要吸收的能量(单位:kJ?mol-1) | 602 | 345.6 | 411 | 357.7 | 458.8 |
| 催化剂 |
| 加热、加压 |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
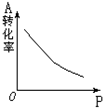 密闭容器中mA(g)+nB(g)?pC(g),反应达到平衡,经测定增大压强P时,A的转化率随P而变化的曲线如图.则:
密闭容器中mA(g)+nB(g)?pC(g),反应达到平衡,经测定增大压强P时,A的转化率随P而变化的曲线如图.则:查看答案和解析>>
科目: 来源: 题型:
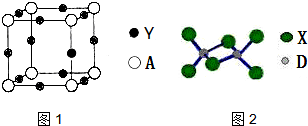 A、B、C、D、E、X为原子序数依次增大的短周期元素,A的基态原子有三个未成对电子,B、E最外层电子数相同,E的核电荷数是B的2倍,C的焰色反应呈黄色,D第三周期中原子半径最小的金属元素,X元素为同周期电负性最大的主族元素.Y为第四周期ⅠB的元素.
A、B、C、D、E、X为原子序数依次增大的短周期元素,A的基态原子有三个未成对电子,B、E最外层电子数相同,E的核电荷数是B的2倍,C的焰色反应呈黄色,D第三周期中原子半径最小的金属元素,X元素为同周期电负性最大的主族元素.Y为第四周期ⅠB的元素.查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com