
科目: 来源: 题型:
 一定条件下,在2L的密闭容器中,发生下述反应:N2(g)+3H2(g)?2NH3(g)△H=-92.4KJ/mol
一定条件下,在2L的密闭容器中,发生下述反应:N2(g)+3H2(g)?2NH3(g)△H=-92.4KJ/mol查看答案和解析>>
科目: 来源: 题型:
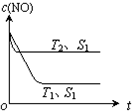 汽车尾气是城市主要空气污染物,研究控制汽车尾气成为保护环境的重要任务.
汽车尾气是城市主要空气污染物,研究控制汽车尾气成为保护环境的重要任务.查看答案和解析>>
科目: 来源: 题型:
 在一定条件下,二氧化硫和氧气发生如下反应:
在一定条件下,二氧化硫和氧气发生如下反应:| 催化剂 |
| △ |
查看答案和解析>>
科目: 来源: 题型:


查看答案和解析>>
科目: 来源: 题型:
 Ⅰ.某实验小组对H2O2的分解做了如下探究.下表是该实验小组研究影响H2O2分解速率的因素时记录的一组数据,将质量相同但状态不同的MnO2分别加入盛有15mL 5%的H2O2溶液的大试管中,并用带火星的木条测试,结果如下:
Ⅰ.某实验小组对H2O2的分解做了如下探究.下表是该实验小组研究影响H2O2分解速率的因素时记录的一组数据,将质量相同但状态不同的MnO2分别加入盛有15mL 5%的H2O2溶液的大试管中,并用带火星的木条测试,结果如下:| MnO2 | 触摸试管情况 | 观察结果 | 反应完成所需的时间 |
| 粉末状 | 很烫 | 剧烈反应,带火星的木条复燃 | 3.5min |
| 块状 | 微热 | 反应较慢,火星红亮但木条未复燃 | 30min |
查看答案和解析>>
科目: 来源: 题型:

| 试剂组合序号 | 固体试剂 | NH3体积(mL) | |
| a | 6.0g Ca(OH)2(过量) | 5.4g NH4Cl | 1344 |
| b | 5.4g (NH4)2SO4 | 1364 | |
| c | 6.0g NaOH(过量) | 5.4g NH4Cl | 1568 |
| d | 5.4g (NH4)2SO4 | 1559 | |
| e | 6.0g CaO(过量) | 5.4g NH4Cl | 1753 |
| f | 5.4g (NH4)2SO4 | 1792 | |
 →
→查看答案和解析>>
科目: 来源: 题型:
 某温度下,在2L密闭容器中3种气态物质间进行反应,X、Y、Z的物质的量随时间的变化曲线如图.反应在t1 min时到达平衡,如图所示:
某温度下,在2L密闭容器中3种气态物质间进行反应,X、Y、Z的物质的量随时间的变化曲线如图.反应在t1 min时到达平衡,如图所示:查看答案和解析>>
科目: 来源: 题型:
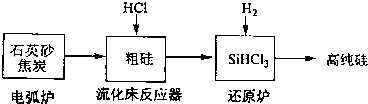
| 发生的主要反应 | |||||
| 电弧炉 | SiO2+2C
| ||||
| 流化床反器 | Si+3HCl
| ||||
| 还原炉 | SiHCl3+H2
|
| 物质 | Si | SiCl4 | SiHCl3 | SiH2Cl2 | SiH3Cl | HCl | SiH4 |
| 沸点/℃ | 2355 | 57.6 | 31.8 | 8.2 | -30.4 | -84.9 | -111.9 |
查看答案和解析>>
科目: 来源: 题型:

| 实验操作 | 预期现象 | 结论 |
| 步骤1:各取少量溶液A分装a、b、c三支试管,往a试管滴加 |
有白色沉淀产生 | 说明溶液A含有Cl- |
| 步骤2:往b试管, |
说明溶液A含有NH4+ | |
| 步骤3:往c试管逐滴加入 |
先产生 后 |
说明溶液A含有Zn2+ |
查看答案和解析>>
科目: 来源: 题型:

| 物质 | SiHCl3 | SiCl4 | AsCl3 |
| 沸点/℃ | 32.0 | 57.5 | 131.6 |
| 一定条件 |
| n(SiHCl3) |
| n(H2) |
| 催化剂 |
| 放电 |
| 充电 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com