
科目: 来源: 题型:
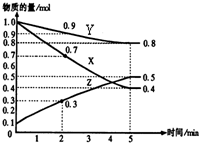 (1)某温度时,在2L密闭容器中,X、Y、Z三种物质的物质的量随时间变化曲线如图所示.由图中数据分析,该反应的化学方程式为:
(1)某温度时,在2L密闭容器中,X、Y、Z三种物质的物质的量随时间变化曲线如图所示.由图中数据分析,该反应的化学方程式为:查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
| CaSO4 | Mg2(OH)2CO3 | CaCO3 | BaSO4 | BaCO3 |
| 2.6×10-2 | 2.5×10-4 | 7.8×10-4 | 2.4×10-4 | 1.7×10-3 |
查看答案和解析>>
科目: 来源: 题型:
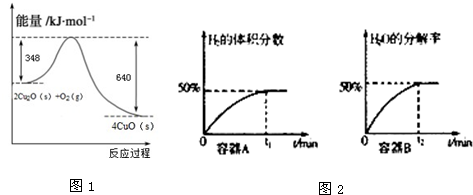
查看答案和解析>>
科目: 来源: 题型:
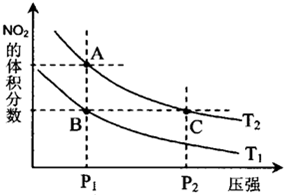 试运用所学知识,解决下列问题:
试运用所学知识,解决下列问题:| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
查看答案和解析>>
科目: 来源: 题型:
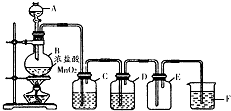 某化学研究小组探究溴化亚铁水溶液与氯气反应.
某化学研究小组探究溴化亚铁水溶液与氯气反应.| 试验 | 操作 | 现象 |
| a | 取少量FeCl2溶液于试管中,滴加少量氯,再滴加2滴KSCN溶液,振荡静置. | 溶液变为血红色 |
| b | 取少量FeCl3溶液于试管中,滴加少量溴化钠溶液和少量CCl4,振荡静置. | CCl4层没有明显变化 |
| c | |
CCl4层由无色变为橙红色 |
查看答案和解析>>
科目: 来源: 题型:
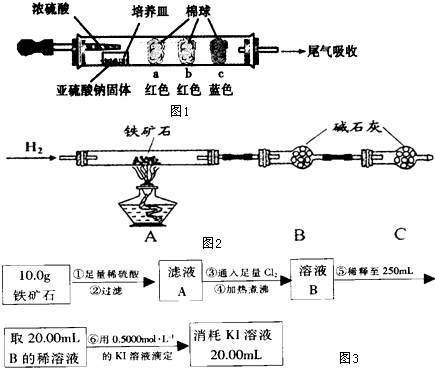
| 棉球 | 棉球上滴加的试剂 | 实验现象 | 解释和结论 |
| a | 棉球变白,微热后又恢复红色 | ||
| b | 含酚酞的NaOH溶液 | 棉球变为白色 | 离子方程式: |
| c | 棉球变为白色 | 该气体具有 |
查看答案和解析>>
科目: 来源: 题型:
| 一定条件 |
| A、使用催化剂不影响反应速率 |
| B、降低体系温度能加快反应速率 |
| C、增加O2的浓度能加快反应速率 |
| D、一定条件下达到反应限度时SO2全部转化为SO3 |
查看答案和解析>>
科目: 来源: 题型:
| A、利用人工光合成反应,探究将二氧化碳转化为碳氢化合物作燃料,属于低碳技术 |
| B、开发安全、高效、低毒及低残留的新型农药 |
| C、加大稀土资源的开采和出口,制造更多高新产品,保证经济快速发展 |
| D、制备物质时探究化学反应中高选择性、转化率和原子利用率,属于“绿色”的生产工艺 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com