
科目: 来源: 题型:
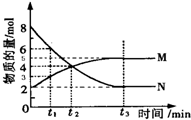 在一定温度下,4L密闭容器内M、N两种物质随时间变化的曲线如图所示:
在一定温度下,4L密闭容器内M、N两种物质随时间变化的曲线如图所示:查看答案和解析>>
科目: 来源: 题型:
 ,已知断裂1mol N-N键吸收167kJ的热量,生成1mol N≡N键放出942kJ热量.试判断相同条件下N4与N2的稳定性顺序是:
,已知断裂1mol N-N键吸收167kJ的热量,生成1mol N≡N键放出942kJ热量.试判断相同条件下N4与N2的稳定性顺序是:查看答案和解析>>
科目: 来源: 题型:
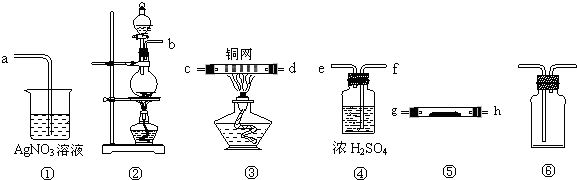
查看答案和解析>>
科目: 来源: 题型:
 A、B、C、D都是中学化学中常见物质,其中A、B、C均含有同一种元素,在一定条件下相互转化关系如图(部分反应中的水已略去).
A、B、C、D都是中学化学中常见物质,其中A、B、C均含有同一种元素,在一定条件下相互转化关系如图(部分反应中的水已略去).查看答案和解析>>
科目: 来源: 题型:
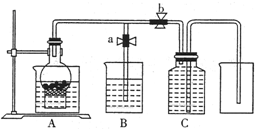 某同学设计如图所示装置来试验用粗铁粒与某浓度稀硝酸反应制取NO气体.
某同学设计如图所示装置来试验用粗铁粒与某浓度稀硝酸反应制取NO气体.
|
最终溶液中的阳离子及其物质的量 | ||||
<
|
|||||
=
|
a mol Fe3+ | ||||
大于
|
|||||
=
|
a mol Fe2+ | ||||
>
|
查看答案和解析>>
科目: 来源: 题型:
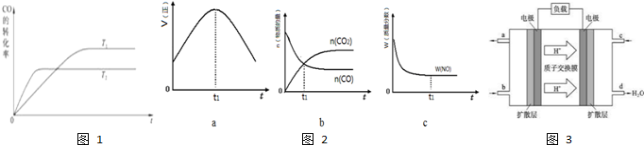
查看答案和解析>>
科目: 来源: 题型:
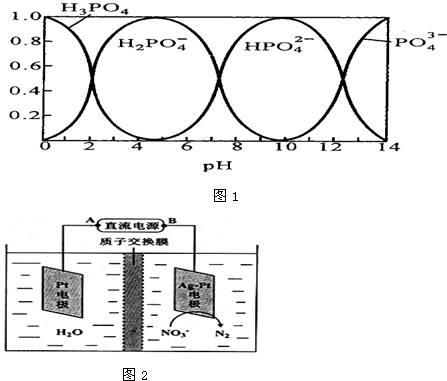
| c(Na+) |
| c(PO43-) |
查看答案和解析>>
科目: 来源: 题型:
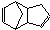 )是一种化学活性很高的烃,存在于煤焦油中.
)是一种化学活性很高的烃,存在于煤焦油中.查看答案和解析>>
科目: 来源: 题型:
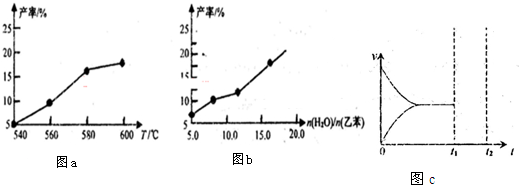
| n(H2O) |
| n(乙苯) |
查看答案和解析>>
科目: 来源: 题型:
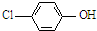 )的废水可以利用微生物电池除去,其原理如图1所示.
)的废水可以利用微生物电池除去,其原理如图1所示.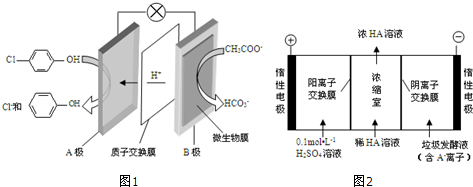
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com