
科目: 来源: 题型:
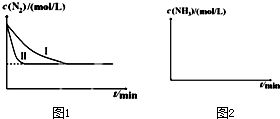
查看答案和解析>>
科目: 来源: 题型:
| 转化的甲醇的物质的量 |
| 催化剂的物质的量 |
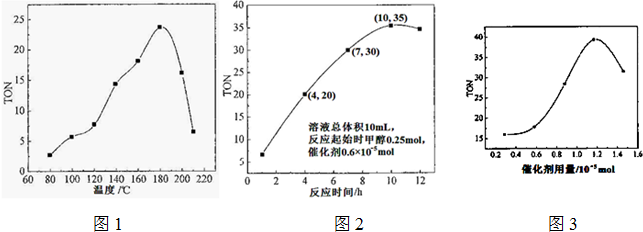
| H2CO3 |
| HCO3- |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
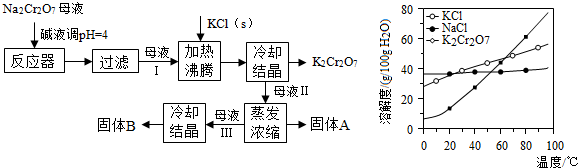
查看答案和解析>>
科目: 来源: 题型:
| 装 置 | 现 象 |
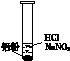 |
ⅰ.实验初始,未见明显现象 ⅱ.过一会儿,出现气泡,液面上方呈浅棕色 ⅲ.试管变热,溶液沸腾 |
| 实 验 | 内 容 | 现 象 |
| 实验1 | 将湿润KI-淀粉试纸置于空气中 | 未变蓝 |
| 实验2 | 用湿润KI-淀粉试纸检验浅棕色气体 | 试纸变蓝 |
| 装 置 | 现 象 |
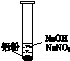 |
ⅰ.实验初始,未见明显现象 ⅱ.过一会儿,出现气泡,有刺激性气味 |
查看答案和解析>>
科目: 来源: 题型:
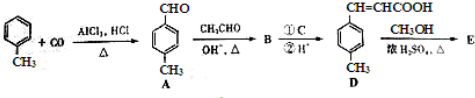
| OH-,△ |
 是E的一种同分异构体,该物质与足量NaOH溶液共热的化学方程式为
是E的一种同分异构体,该物质与足量NaOH溶液共热的化学方程式为查看答案和解析>>
科目: 来源: 题型:
| A、离子晶体中,只存在离子键,不可能存在其它化学键 |
| B、在氧族元素(O、S、Se、Te)的氢化物中,水的沸点最低 |
| C、NaHSO4、Na2O2晶体中的阴阳离子个数比均为1:2 |
| D、晶体的熔点:金刚石>碳化硅>单晶硅 |
查看答案和解析>>
科目: 来源: 题型:
| A、离子半径 H->Li+ |
| B、熔点 Al2O3>MgO |
| C、结合质子(H+)的能力 CO32->ClO- |
| D、密度 1-氯戊烷>1-氯己烷 |
查看答案和解析>>
科目: 来源: 题型:
A、羟基乙酸(HOCH2COOH)的缩聚物: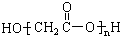 |
B、H2O2的分子结构模型示意图: |
| C、在CS2、PCl5中各原子最外层均能达到8电子的稳定结构 |
| D、淀粉和纤维素的实验式都为 CH2O |
查看答案和解析>>
科目: 来源: 题型:
| A、反应A2(g)+3B2(g)═2AB3(g)在一定温度下能自发进行,则该反应的△H<0 |
| B、将NH3 通入热的CuSO4 溶液中能使Cu2+还原成Cu |
| C、钙和镁的氯化物溶液蒸发结晶出来的固体都是水合物,经焙烧得相应无水盐 |
| D、用酸溶解金属铝时,溶解的速率与铝的纯度有关,纯度越高速率越大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com