
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:

查看答案和解析>>
科目: 来源: 题型:
 通常人们把拆开1mol某化学键所吸收的能量看成该化学键的键能.键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(△H),下表为一些常见化学键键能值.
通常人们把拆开1mol某化学键所吸收的能量看成该化学键的键能.键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(△H),下表为一些常见化学键键能值.| 化学键 | Si-O | Si-Cl | H-H | H-Cl | Si-Si | Si-C |
| 键能/kJ?mol-1 | 460 | 360 | 436 | 431 | 176 | 347 |
查看答案和解析>>
科目: 来源: 题型:
| 元素A | 元素B | 元素C | 元素X | 元素Y | 元素Z |
| 单质是一种常见金属,与元 素X形成黑色和红棕色三种常见化合物 |
单质是一种黄绿色气体 | 短周期中金属性最强,与X 反应能生成两种常见化合物 |
最外层电子数是内层电子数的3倍,能形 成双原子阴离子 |
单质为双原子分子,结构中б键与π键数 目比为1:2 |
阳离子就是一个质子 |
查看答案和解析>>
科目: 来源: 题型:
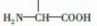

查看答案和解析>>
科目: 来源: 题型:
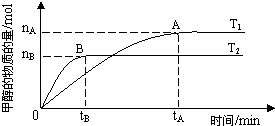
| n(H2) |
| n(CH3OH) |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
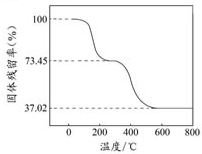 碱式碳酸铝镁[MgaAlb(OH)c(CO3)d?xH2O]常用作塑料阻燃剂.
碱式碳酸铝镁[MgaAlb(OH)c(CO3)d?xH2O]常用作塑料阻燃剂.| 固体样品的剩余质量 |
| 固体样品的起始质量 |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com