
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
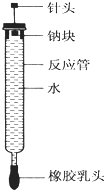 有人设计了如图所示的实验装置来探究钠与水反应(铁架台等仪器略去).实验前在橡胶塞下端打一个小孔穴,将一大小适中的钠块固定于针头下端,向上抽动针头使钠块藏于孔穴内.在玻璃反应管内装入适量水(使钠块不与水接触).实验时,拔去橡胶乳头,按住橡胶塞,将针头缓缓向上拔起使钠与水接触,反应管内的液体被产生的气体压出,流入置于下方的烧杯中,气体则被收集在反应管内.
有人设计了如图所示的实验装置来探究钠与水反应(铁架台等仪器略去).实验前在橡胶塞下端打一个小孔穴,将一大小适中的钠块固定于针头下端,向上抽动针头使钠块藏于孔穴内.在玻璃反应管内装入适量水(使钠块不与水接触).实验时,拔去橡胶乳头,按住橡胶塞,将针头缓缓向上拔起使钠与水接触,反应管内的液体被产生的气体压出,流入置于下方的烧杯中,气体则被收集在反应管内.查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
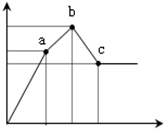 向100mL0.1mol/L硫酸铝铵[NH4Al(SO4)2]溶液中逐滴滴入0.1mol/L Ba(OH)2溶液.随着Ba(OH)2溶液体积V(横坐标)的变化,沉淀总物质的量n的变化如图所示,
向100mL0.1mol/L硫酸铝铵[NH4Al(SO4)2]溶液中逐滴滴入0.1mol/L Ba(OH)2溶液.随着Ba(OH)2溶液体积V(横坐标)的变化,沉淀总物质的量n的变化如图所示,查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com