
科目: 来源: 题型:
 一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):
一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):| 1 |
| 2 |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
| 元素编号 元素性质 |
① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
| 原子半径(10-10m) | 1.52 | 2.27 | 0.74 | 1.43 | 0.77 | 1.10 | 0.99 | 1.86 | 0.75 | 0.71 |
| 最高价态 | +1 | +1 | / | +3 | +4 | +5 | +7 | +1 | +5 | / |
| 最低价态 | / | / | -2 | / | -4 | -3 | -1 | / | -3 | -1 |
查看答案和解析>>
科目: 来源: 题型:
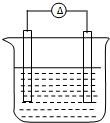 铁片和铜片浸入200mL CuSO4溶液中组成如图所示原电池,若开始时该电池中两电极的总质量为60克,工作一段时间后,硫酸铜恰好反应完.取出铁片和铜片,洗净干燥后称重,总质量为61.6克,试计算:(不考虑铁片直接和硫酸铜的反应)
铁片和铜片浸入200mL CuSO4溶液中组成如图所示原电池,若开始时该电池中两电极的总质量为60克,工作一段时间后,硫酸铜恰好反应完.取出铁片和铜片,洗净干燥后称重,总质量为61.6克,试计算:(不考虑铁片直接和硫酸铜的反应)查看答案和解析>>
科目: 来源: 题型:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| H2O | CO | H2 | CO | |||
| 1 | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
查看答案和解析>>
科目: 来源: 题型:
| 温度/℃ | 400 | 500 | 830 | 1000 |
| 平衡常数K | 10 | 9 | 1 | 0.6 |
| A | B | C | D | |
| n(CO2) | 3 | 1 | 0 | 1 |
| n(H2) | 2 | 1 | 0 | 1 |
| n(CO) | 1 | 2 | 3 | 0.5 |
| n(H2O) | 5 | 2 | 3 | 2 |
查看答案和解析>>
科目: 来源: 题型:
| 1 |
| 2 |
查看答案和解析>>
科目: 来源: 题型:
| 1 | |
| 2 | |
| 3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com