
科目: 来源: 题型:
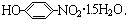 .
. )的电离平衡常数K2的相对大小
)的电离平衡常数K2的相对大小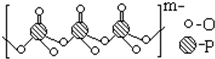
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
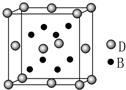 已知A、B、C、D、E是元素周期表中1~36号元素,其原子序数依次增大,且A、B、C、D为主族元素.A与另外四种元素既不在同一周期,也不在同一主族.B和C同主族,D和E同周期;元素E是周期表中的第7列元素,D的最外层电子数与最内层电子数相同,D跟B可形成离子化合物,其晶胞结构(其中B原子在晶胞内部)如图.
已知A、B、C、D、E是元素周期表中1~36号元素,其原子序数依次增大,且A、B、C、D为主族元素.A与另外四种元素既不在同一周期,也不在同一主族.B和C同主族,D和E同周期;元素E是周期表中的第7列元素,D的最外层电子数与最内层电子数相同,D跟B可形成离子化合物,其晶胞结构(其中B原子在晶胞内部)如图.查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
| 温度(K) CO2转化率% n(H2)/n(CO2) |
500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2.0 | 60 | 43 | 28 | 15 |
| 3.0 | 83 | 62 | 37 | 22 |
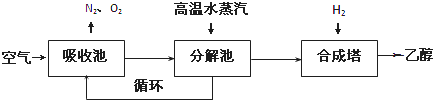
查看答案和解析>>
科目: 来源: 题型:

查看答案和解析>>
科目: 来源: 题型:
| ||
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
| T/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com