
科目: 来源: 题型:
| A、CS2的结构式为:S=C=S | |||
B、6CO2+6H2O
| |||
| C、CO2(g)+C(s)?2CO(g)△H>0,△S>0,该反应常温下能自发进行 | |||
| D、NH3水溶液呈碱性的原因是NH3+H2O?NH3?H2O?NH4++OH- |
查看答案和解析>>
科目: 来源: 题型:
| A、HCO3- |
| B、CO32- |
| C、H+ |
| D、OH- |
查看答案和解析>>
科目: 来源: 题型:
| A、1mol 氧气中含有12.04×1023个氧原子,在标准状况下占有体积22.4 L |
| B、等体积、浓度均为1mol/L的碳酸和盐酸,电离出的氢离子数之比为2:1 |
| C、1mol臭氧和1.5mol氧气含有相同的氧原子数 |
| D、等物质的量的干冰和葡萄糖(C6H12O6)中所含氧原子数之比为1:3 |
查看答案和解析>>
科目: 来源: 题型:
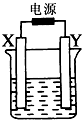 如图装置中X和Y均为石墨电极,电解液为500mL某蓝色溶液,电解一段时间,观察到X电极表面有红色的固态物质生成,Y电极有无色气体生成;溶液中原有溶质完全电解后,停止电解,取出X电极,洗涤、干燥、称量,电极增重1.6g.下列有关说法中不正确的是( )
如图装置中X和Y均为石墨电极,电解液为500mL某蓝色溶液,电解一段时间,观察到X电极表面有红色的固态物质生成,Y电极有无色气体生成;溶液中原有溶质完全电解后,停止电解,取出X电极,洗涤、干燥、称量,电极增重1.6g.下列有关说法中不正确的是( )| A、X电极是阴极 |
| B、Y电极产生气体的体积为0.224L |
| C、电解后溶液的pH=1 |
| D、要使电解后溶液恢复到电解前的状态,需加入一定量的CuO或CuCO3 |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
| 族 周期 |
I A | ⅡA | ⅢA | ⅣA | VA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | ? | ? |
查看答案和解析>>
科目: 来源: 题型:
| 族 周 期 |
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |
查看答案和解析>>
科目: 来源: 题型:
| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需 时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
| a |
| b |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com